Щелочные металлы. Элементы IA-группы
Щелочные металлы. Элементы IA-группы
Ключевые слова конспекта: щелочные металлы, элементы IA-группы, литий, натрий, цезий, калий, рубидий, надпероксиды, пероксид натрия, щелочи, получение и применение щелочных металлов.
Щелочными металлами называют элементы IA-группы Периодической системы. Групповое название «щелочные» обусловлено тем, что растворимые в воде гидроксиды натрия и калия известны с древних времён, их называли щелочами. Важнейшие параметры этих элементов приведены в таблице.
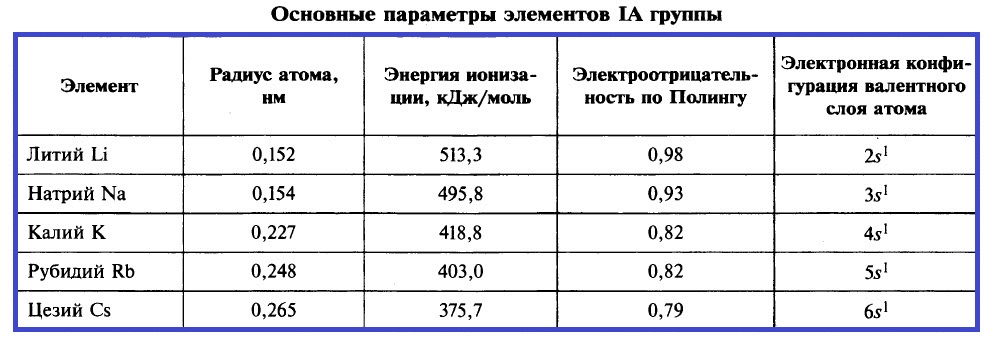
Вы видите, как меняются свойства элементов в подгруппе: от лития к цезию радиусы атомов увеличиваются, значения энергии ионизации и электроотрицательности уменьшаются, металлические свойства усиливаются.
Электронная конфигурация валентного электронного слоя атомов щелочных металлов ns1, где n – номер валентного энергетического уровня. Щелочные металлы являются s-элементами.
В соединениях щелочных металлов преобладает ионный характер связи. В своих соединениях щелочные металлы могут быть только одновалентны. Во всех своих соединениях щелочные металлы имеют степень окисления +1.
Высшими оксидами являются соединения состава Ме2O, они имеют ярко выраженный основный характер. Высшие гидроксиды щелочных металлов МеОН – типичные основания, щёлочи. Водородные соединения щелочных металлов – твёрдые гидриды состава МеН.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
Щелочные металлы – вещества немолекулярного строения, их кристаллическая решётка металлическая.
При обычных условиях щелочные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро тускнеют вследствие окисления), лёгкие (литий – самый лёгкий металл, его плотность составляет 0,53 г/см3), легкоплавкие, мягкие (легко режутся ножом).
При внесении щелочных металлов или их соединений в бесцветное пламя оно приобретает характерную окраску:
|
Элемент |
Окраска пламени | Элемент |
Окраска пламени |
|
Li |
карминово-красная |
Rb |
розовато-фиолетовая |
|
Na |
жёлтая |
Cs |
фиолетово-синяя |
|
К |
бледно–фиолетовая |
Щелочные металлы являются активными восстановителями. В атмосфере хлора и фтора они воспламеняются при обычных условиях.
Взаимодействие щелочных металлов с жидким бромом сопровождается взрывом.
Нагретые щелочные металлы легко сгорают на воздухе или в кислороде, но только при сгорании лития образуется оксид:![]()
При сгорании натрия обычно образуется пероксид (Na2O2):![]()
Пероксид натрия Na2O2 – кристаллы светло-жёлтого цвета – можно рассматривать как соль пероксида водорода H2O2.
При сгорании остальных щелочных металлов образуются надпероксиды (например, КO2). Получить оксиды Na2О, К2O, Rb2O, Cs2O можно восстановлением пероксидов и надпероксидов щелочными металлами, например, по реакции: КO2 + 3К = 2К2O
Щелочные металлы взаимодействуют с серой при нагревании.
Литий – единственный металл, который реагирует с азотом с образованием нитрида уже при комнатной температуре:![]()
Остальные щелочные металлы с азотом не реагируют (натрий реагирует с азотом при 100 °С, при электрическом разряде).
При нагревании щелочные металлы взаимодействуют с водородом с образованием твёрдых гидридов:![]()
Щелочные металлы активно взаимодействуют с водой с образованием щёлочи и водорода. При этом кусочек лития или натрия с шипением «бегает» по поверхности воды, при взаимодействии калия происходит возгорание выделяющегося водорода (бледно-фиолетовое пламя), рубидий и цезий взаимодействуют со взрывом: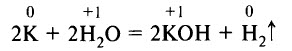
Щелочные металлы активно реагируют с разбавленными кислотами с образованием соли и водорода, но при этом параллельно протекают реакции щелочного металла с водой и образовавшейся щёлочи с кислотой.
Иначе протекают реакции с концентрированными растворами кислот или с самими кислотами – сильными окислителями, например с азотной и серной. В этих реакциях происходит восстановление азота в высшей степени окисления (в HNO3) или серы в высшей степени окисления (в H2SO4). Образуется соль, продукт восстановления азота или серы и вода: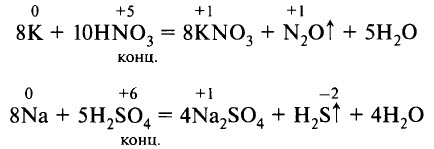
Щелочные металлы активно взаимодействуют с растворами солей, но при этом происходит не замещение металла, входящего в состав соли, щелочным металлом, а прежде всего взаимодействие щелочного металла с водой раствора.
Натрий получают электролизом расплава поваренной соли (с добавками СаCl2 для понижения температуры плавления смеси):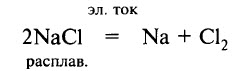
Щелочные металлы находят широкое применение в промышленности и в технике:
- литий – в литий-ионных аккумуляторах, в термоядерной энергетике для получения изотопа водорода – трития, а также в качестве теплоносителя в ядерных реакторах;
- натрий используют как теплоноситель в ядерных реакторах, для синтеза некоторых органических соединений (например, как катализатор в синтезе каучука, как активный восстановитель в других реакциях, часто в сплаве с калием), в металлотермии (натрийтермия);
- цезий легко теряет электроны даже под действием света, поэтому он применяется в фотоэлементах.
Наиболее распространёнными соединениями щелочных металлов являются (приведены исторические названия):
NaOH – едкий натр (каустическая сода),
NaCl – поваренная соль,
NaNO3 – чилийская селитра,
Na2SO4 • 10H2O – глауберова соль,
Na2CO3 • 10H2O – сода кристаллическая,
КОН – едкое кали,
КCl – хлорид калия, входит в состав калийной соли (NaCl • КCl + КCl),
KNO3 – индийская селитра,
К2СO3 – поташ.
Конспект урока по химии «Щелочные металлы. Элементы IA-группы». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии