Окислители и восстановители
Окислители и восстановители
Ключевые слова конспекта: окислители, восстановители, окисление, восстановление.
Окислитель – вещество, атомы, молекулы или ионы которого принимают электроны. Восстановитель – вещество, атомы, молекулы или ионы которого отдают электроны. Окислителем и восстановителем могут также называть элементы, атомы которых отдают или принимают электроны. Если элемент является окислителем – его степень окисления понижается; если элемент является восстановителем – его степень окисления повышается.
Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Окислители
Среди простых веществ окислительные свойства характерны для типичных неметаллов (F2, Cl2, Вг2, I2, O2, О3). Галогены, выступая в качестве окислителей, приобретают степень окисления –1, причём от фтора к йоду окислительные свойства ослабевают. Кислород, восстанавливаясь, приобретает степень окисления –2 (Н2O или ОН–).
Среди кислородсодержащих кислот и их солей к наиболее важным окислителям относятся концентрированная серная кислота, азотная кислота и нитраты, перманганаты МnO4–, хроматы СrO42– и дихроматы Сr2O72–.
Концентрированная серная кислота проявляет окислительные свойства за счёт серы в высшей степени окисления +6. Продуктами восстановления серы могут быть: SO2 (степень окисления серы +4), сера – простое вещество (степень окисления серы 0), сероводород (степень окисления серы –2).
Азотная кислота проявляет окислительные свойства за счёт азота в высшей степени окисления +5, причём окислительная способность HNO3 усиливается с ростом её концентрации. Состав продуктов восстановления азотной кислоты зависит от активности восстановителя, концентрации кислоты и температуры системы; чем активнее восстановитель и ниже концентрация кислоты, тем глубже происходит восстановление азота.
Кислородсодержащие кислоты галогенов (например, HClO, HClO3, НВrO3) и их соли, действуя в качестве окислителей, обычно восстанавливаются до степени окисления галогена –1 (в случае хлора и брома) и 0 (в случае иода). Например:
5КСlO3 + 6Р = 5КCl + 3Р2O5
Водород в степени окисления +1 выступает как окислитель преимущественно в растворах кислот (как правило, при взаимодействии с металлами, расположенными в раду напряжений до водорода):
Zn + H2SO4 (разб.) = ZnSO4 + Н2↑
При взаимодействии с сильными восстановителями в качестве окислителя может проявлять себя и водород, входящий в состав воды:
2Н2O + 2Na = 2NaOH + Н2↑
Н2O + NaH = NaOH + Н2↑
Ионы металлов, находящихся в высшей степени окисления (например, Fe3+, Hg2+, Cu2+), выполняя функцию окислителей, превращаются в ионы с более низкой степенью окисления:
2FeCl3 + H2S = 2FeCl2 + S + 2HCl
Восстановители
Среди простых веществ к типичным восстановителям принадлежат активные металлы (щелочные и щёлочноземельные, алюминий, цинк, железо и др.), а также некоторые неметаллы, такие, как водород, углерод (в виде угля или кокса), фосфор, кремний. При этом в кислой среде металлы окисляются до положительно заряженных ионов.
Углерод чаще всего окисляется до монооксида СО или диоксида СO2; фосфор при действии сильных окислителей окисляется до ортофосфорной кислоты Н3РO4.
В бескислородных кислотах (НCl, НВг, HI, H2S) и их солях восстановителями являются анионы, которые, окисляясь, обычно образуют простые вещества. В ряду галогенид-ионов восстановительные свойства усиливаются от Cl– к I–.
Металлы в промежуточной степени окисления (ионы Sn2+, Fe2+, Cu+, Hg2+ и др.), взаимодействуя с окислителями, способны повышать свою степень окисления:
2FeCl2 + Cl2 = 2FeCl3
10FeSO4 +2KMnO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
Образец выполнения задания ОГЭ.
Задание. Степень окисления азота в аммиаке и нитрате калия соответственно
1) –2 и +5
2) –3 и +5
3) +3 и +5
4) –4 и +3
Решение. Определим степени окисления элементов в аммиаке и нитрате натрия:
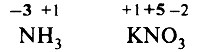
Обратим внимание, что в аммиаке степень окисления азота – отрицательная, так как электроотрицательность азота выше, чем электроотрицательность водорода.
Правильный ответ: 2) –3 и +5.
Конспект урока по химии «Окислители и восстановители».
Темы, связанные с настоящим конспектом:
- Степень окисления химических элементов
- Метод электронного баланса
- Окислительно-восстановительные реакции