Карбонаты и силикаты
Карбонаты и силикаты
Ключевые слова конспекта: ионные соединения, карбонаты, силикаты, сода, гидролиз, гашение соды, приготовление теста.
Как и большинство солей, карбонаты и силикаты можно отнести к ионным соединениям.
Формулы для силикатов Men(SiO3)m отражают только соотношение элементов, но не истинный состав силикат-анионов, который, как и в случае с кремниевой кислотой, более сложен.
При обычных условиях карбонаты и силикаты – твёрдые вещества, бесцветные, если катион металла не даёт характерную окраску. В воде растворимы только карбонаты и силикаты щелочных металлов (кроме Li) и (NH4)2CO3. Гидрокарбонаты металлов, в которых катионы имеют заряд 2+, как правило, лучше растворимы в воде, чем карбонаты.
Химические особенности карбонатов и силикатов
- Растворимые карбонаты и силикаты подвергаются гидролизу в водных растворах:
Na2CO3 + H2O ⇆ NaHCO3 + NaOH
CO32– + H2O ⇆ НСО3– + OH–
При обычных условиях гидролиз протекает преимущественно по I ступени.
- Карбонаты и растворимые силикаты взаимодействуют с более сильными кислотами.
В быту часто проводится реакция гашения соды, когда готовят тесто. Питьевую соду NaHCO3 обрабатывают уксусом (раствором уксусной кислоты):
NaHCO3 + СH3СООН = CH3COONa + CO2↑ + H2O
НСO3– + СH3СООН = CO2↑ + H2O + CH3COO–
В этой реакции уксусная кислота вытесняет из соли слабую и летучую угольную кислоту, которая разлагается на углекислый газ и воду. Образующийся углекислый газ поднимает тесто.
С сильными кислотами взаимодействуют и растворимые силикаты, при этом образуется гель кремниевой кислоты переменного состава. Условно этот процесс можно отразить с помощью ионного уравнения:
S1O3– + 2Н+ = H2SiO3↓
- Карбонаты разлагаются при нагревании:
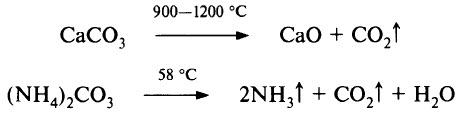
Более устойчивы к нагреванию карбонаты щелочных металлов, они плавятся без разложения (кроме Li2СO3) при 800–900 °С и разлагаются при температуре около 1000 °С. Вообще, термическая устойчивость карбонатов изменяется в широких пределах. Например, ВеСО3 разлагается при температуре ниже 100 °С, а у ВаСO3 полная диссоциация наблюдается при 1300 °С.
Наиболее известными карбонатами являются: Na2CO3 – сода кальцинированная, Na2CO3 • 10H2O – сода кристаллическая, К2СО3 – поташ. Соединение MgCO3 образует минерал магнезит, а СаСО3 – известняк, мел, мрамор, кальцит (исландский шпат), (СuОН)2СО3 образует малахит. Концентрированный раствор силиката натрия Na2SiO3 используется как силикатный клей.
Конспект урока по химии «Карбонаты и силикаты». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
Ещё конспекты по теме «Углерод и кремний«: