Свойства простых веществ: Фосфор
Свойства простых веществ: Фосфор
Ключевые слова конспекта: свойства простых веществ, фосфор, строение и физические свойства, химические свойства, производство и применение фосфора.
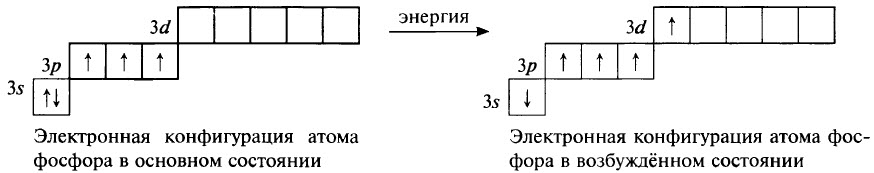
Фосфор – элемент группы VA. Его важнейшие параметры приведены в таблице.
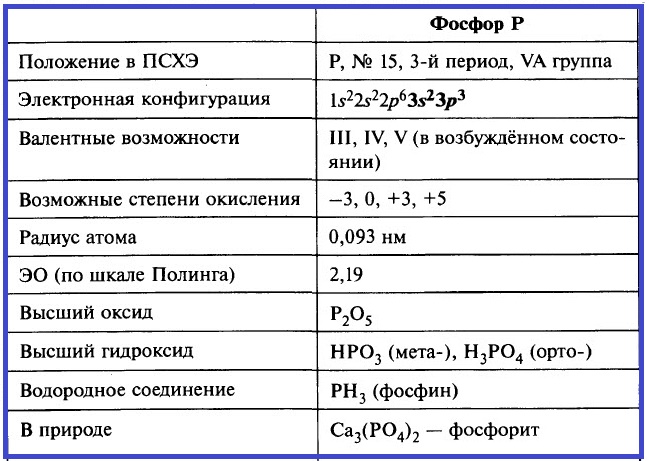
На валентном слое атома фосфора, в отличие от азота, есть вакантные 3d-орбитали. В отличие от азота, фосфор может быть пятивалентным. В этом случае атомы фосфора находятся в возбуждённом состоянии:
СТРОЕНИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Элемент фосфор образует несколько простых веществ, среди которых наиболее известны белый, красный и чёрный фоcфоp.
Белый фосфор состоит из тетраэдрических молекул Р4. В молекуле все связи одинарные ковалентные неполярные. С Р4 связи Р – Р легко разрываются. Этим объясняется высокая химическая активность белого фосфора и его склонность переходить (при хранении или при нагревании) в более стабильные полимерные модификации.
При обычных условиях это твёрдое белое вещество, мягкое как воск (легко режется ножом), летучее при слабом нагревании, легкоплавкое (t°пл = 44 °С), практически нерастворимое в воде (его хранят под слоем воды), хорошо растворимое в неполярных растворителях (например, в сероуглероде CS2). Уже при обычных условиях легко испаряется и в газообразном состоянии окисляется кислородом воздуха, освобождающаяся в результате окисления энергия выделяется в виде света, что и является причиной свечения белого фосфора на воздухе.
Красный фосфор образован полимерными молекулами Рn разной длины, состоящими из пирамидально связанных атомов. Название «красный фoсфoр» используют для описания нескольких различных модификаций фосфора красного цвета.
Красный фocфор – это твёрдое аморфное вещество красного цвета (от тёмно-коричневого до красного и фиолетового), возгоняется при нагревании. При конденсации паров образуется белый фосфop. Красный фoсфoр нерастворим ни в воде, ни в сероуглероде, ни в других растворителях.
Чёрный фосфор представляет собой вещество немолекулярного строения, кристаллическая решётка атомно–слоистая, с характерным для фосфора пирамидальным расположением связей. Чёрный фосфор твёрдый, по внешнему виду похож на графит, проводит электрический ток, имеет высокую t°пл (587 °С).
ХИМИЧЕСКИЕ СВОЙСТВА ФОСФОРА
Фосфор – более активное вещество, чем азот. Фосфору присуща окислительно-восстановительная двойственность. По отношению к металлам фосфор выступает в роли окислителя, образуя фосфиды: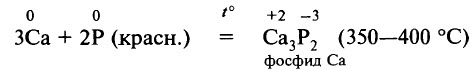
По отношению к большинству неметаллов фосфop выступает в роли восстановителя. При недостатке окислителя обычно образуются соединения фосфора(III), при избытке – соединения фосфора(V), например, РCl3 и РCl5.
Фосфор сгорает на воздухе и в кислороде. Белый фосфор самовоспламеняется в атмосфере кислорода. На воздухе белый фосфор воспламеняется при 50 °С, красный – при температуре выше 250 °С, чёрный – при температуре выше 400 °С. При этом образуются оксиды фосфора. В избытке кислорода образуется оксид фосфора (V):![]()
При нагревании выше 100 °С фосфор бурно взаимодействует с серой с образованием смеси сульфидов (P2S5, P2S3):![]()
Красный и белый фocфор самовозгораются в атмосфере фтора и хлора:![]()
С водородом и азотом фосфор практически не взаимодействует.
Фосфор восстанавливает азотную и серную концентрированные кислоты, хлораты и некоторые другие окислители. Так, например, каждый раз, зажигая спичку, мы проводим реакцию между бертолетовой солью, которая входит в состав спичечной головки, и красным фосфором, нанесённым на спичечный коробок:
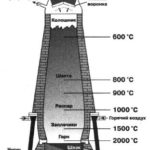
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ФОСФОРА
Сырьём для получения фосфора являются фосфориты, основной компонент которых – ортофосфат кальция. Фосфорит измельчают, смешивают с песком и углём и прокаливают в электропечах без доступа воздуха. Происходит восстановление фосфора:![]()
Основная область использования фосфора – производство спичек. Кроме того, фocфор применяется в металлургии для синтеза фосфорорганических соединений, к числу которых относятся очень ядовитые средства для борьбы с вредителями–насекомыми (инсектициды). Фoсфор используется для получения некоторых полупроводников (фосфидов галлия GaP и индия InP). Фоcфoр также используется для получения оксида фосфора (V), который является сильным водоотнимающим реагентом.
Вся информация о Фосфоре в одной таблице

Конспект урока «Свойства простых веществ: Фосфор».
Следующая тема: «».