Оксиды (названия, классификация, получение)
«Оксиды (названия, классификация, получение)»
Ключевые слова конспекта: оксиды, названия оксидов, классификация оксидов, получение оксидов, химические свойства.
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2.
К примеру, оксидом является соединение P2O5. А вот РН3 и H3PO4 — не являются оксидами, потому что в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов, а не двух.
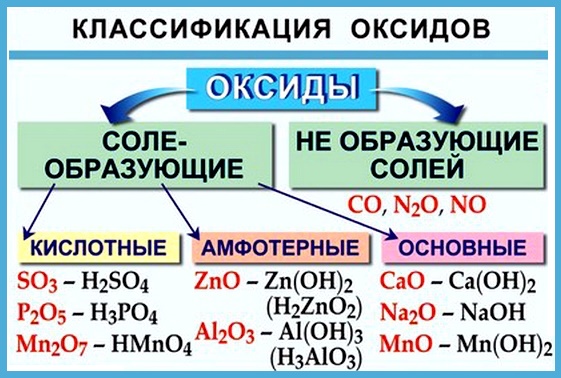
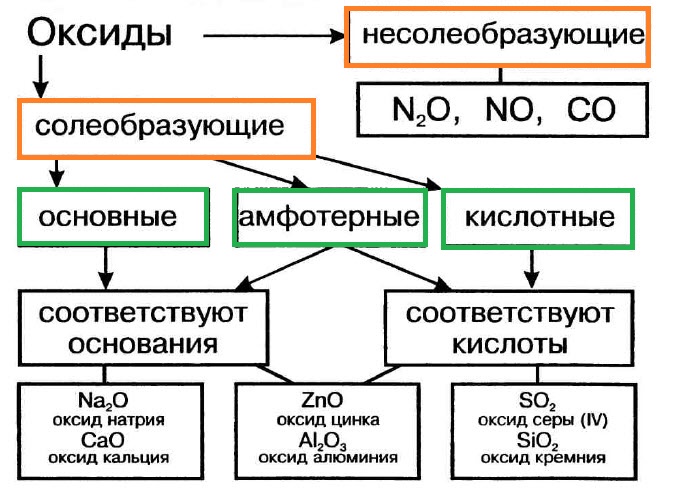
Оксиды подразделяют на солеобразующие (основные, кислотные, амфотерные) и несолеобразующие (безразличные). Особое положение у оксида «вода».
Названия оксидов
Названия оксидов состоят из двух слов: 1-е – «оксид», 2-е – название элемента в родительном падеже. Например, СаО – оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Например: Fe2О3— оксид железа (III), FеО — оксид железа (II). Если у элемента постоянная валентность, то ее не обозначают в названии.
Некоторые оксиды имеют особые (тривиальные) названия: Н2О — вода, СО — угарный газ, СО2 — углекислый газ и др.

Если элемент образует оксиды в нескольких степенях окисления, то оксид с наименьшей валентностью – низший оксид, а с наибольшей – высший оксид. Так, оксид хрома (II) СгО – низший оксид, а оксид хрома (VI) СгO3 – высший оксид.
Классификация оксидов
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими (безразличными): H2O, CO, N2O, NO, F2O. Безразличные оксиды образуются только неметаллами.
Вот некоторые правила образования солеобразующих оксидов:
- неметаллы образуют только кислотные оксиды;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
Предсказать свойства оксида металла может помочь эта схема.
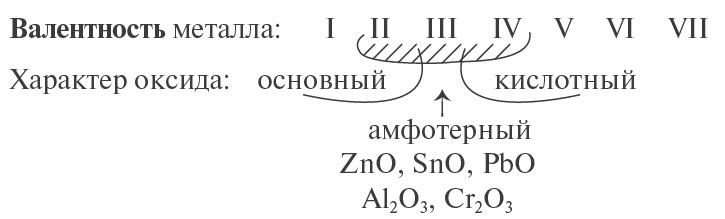
Основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Валентность металлов в амфотерных оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов.
Схема определения типа оксида: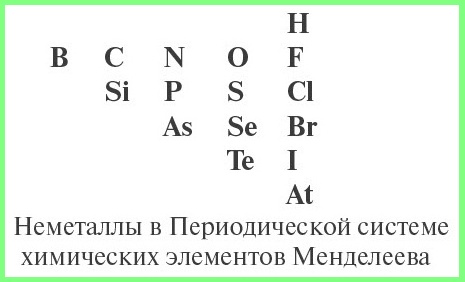
- определить, не является ли данный оксид несолеобразующим;
- определить, какой элемент входит в состав оксида: металл или неметалл, для чего нужно знать из таблицы Менделеева символы элементов — неметаллов.
- если в состав оксида входит атом неметалла — то оксид кислотный;
- для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
Например:
- Сг2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- CrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
Получение оксидов
Oксиды образуются при взаимодействии простых и сложных веществ с кислородом:
4Аl + 3O2 = 2Аl2O3; Si + O2 = SiO2;
SiH4 + 2O2 = SiO2 + 2Н2O; 2Н2S + 3O2 = 2SO2 + 2Н2O.
В реакциях с простыми веществами из одних оксидов могут получаться другие оксиды:
Fe2O3 + С = 2FeO + СО; 2CuO + Н2 = Сu2O + Н2O.
Oксиды образуются при разложении некоторых сложных веществ, обычно при нагревании:
СаСO3 = СаО + СO2; 2Аl(ОН)3 = Аl2O3 + 3Н2O.
Химические свойства оксидов
1. При разложении (при нагревании) неустойчивых оксидов – оксида серебра Ag2O и оксида ртути (II) HgO – образуется соответствующий металл и кислород:
2Ag2O = 4Ag + O2 ↑, 2HgO = 2Hg + O2 ↑.
2. Некоторые oксиды при нагревании образуют другие оксиды. Так, из красного оксида хрома (VI) получается зеленый оксид хрома (III): 4СrO3 = 2Сr2O3 + 3O2 ↑.
3. Некоторые oксиды металлов и неметаллов реагируют с водой:
СаО + Н2O = Са(ОН)2, SO3 + Н2O = Н2SO4.
4. Oксиды металлов обычно реагируют с оксидами неметаллов:
СаО + SO2 = CaSO3, MgO + СO2 = MgCO3.
Реакции оксидов с основаниями, кислотами и солями будут рассмотрены позже.
Конспект урока «Оксиды (названия, классификация, получение, свойства)».
Следующая тема: «Свойства солеобразующих оксидов».