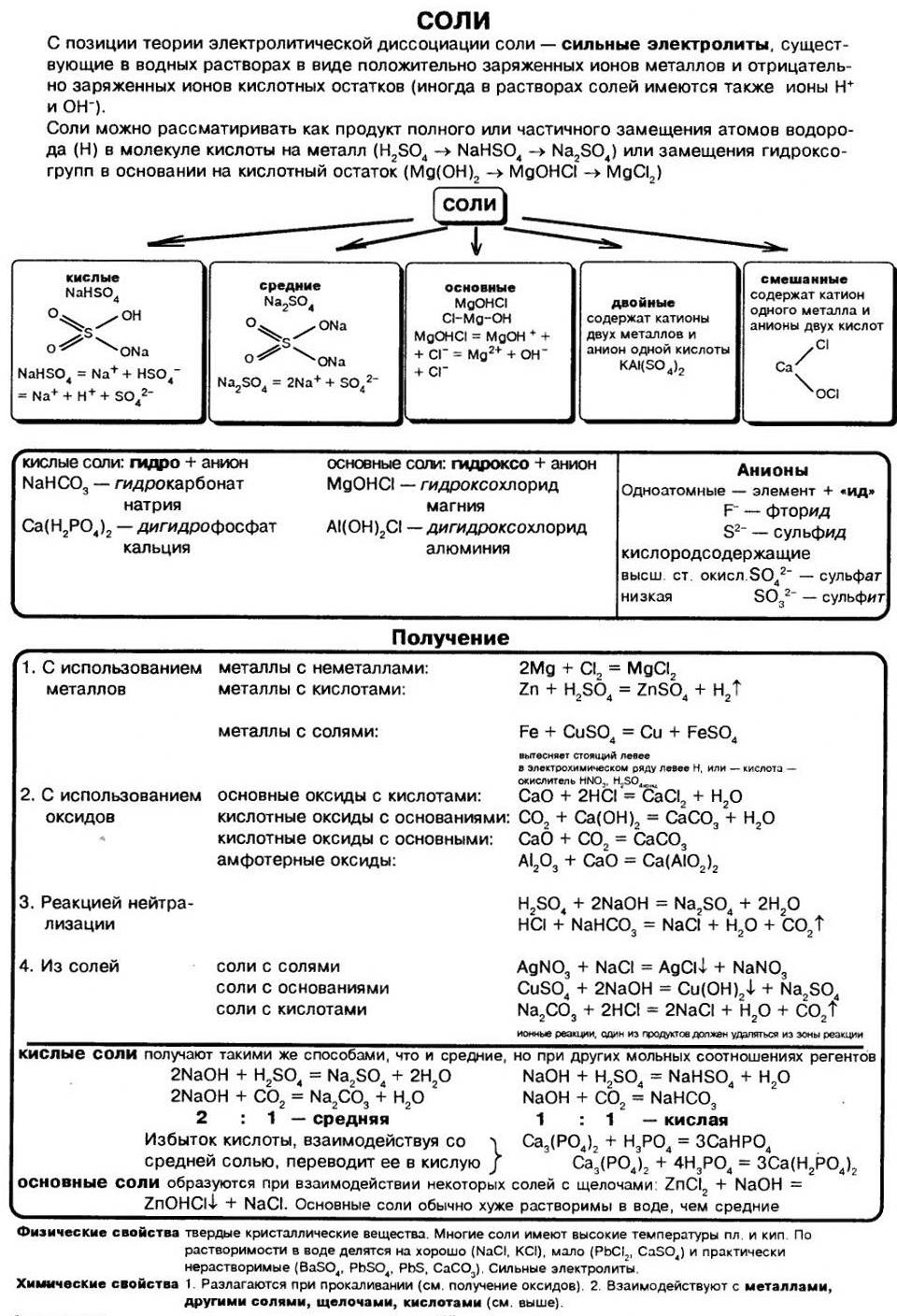
Соли: классификация, свойства, получение
Соли: классификация, свойства, получение
Ключевые слова конспекта: определение солей, классификация, физические и химические свойства соли, получение средних и кислых солей.
ОПРЕДЕЛЕНИЕ, КЛАССИФИКАЦИЯ
И ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка. Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
При обычных условиях все соли – твёрдые вещества. Многие соли не имеют цвета, но некоторые ионы придают солям характерную окраску:
Растворимость солей различна. Практически все нитраты, соли натрия, калия, рубидия, цезия и аммония NH4+ растворимы. Среди сульфидов и фосфатов растворимы только фосфаты и сульфиды щелочных металлов.
ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ
- Соли взаимодействуют с металлами. Более активные металлы (более активные восстановители) вытесняют менее активные из растворов их солей:
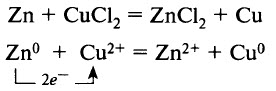
В этом примере ионы меди Cu2+ являются окислителем, а цинк – восстановителем.
Активность металла определяется его положением в электрохимическом ряду напряжений металлов:
Li, Cs, К, Ва, Са, Na, Mg, Al, Zn, Cr, Fe, Co, Ni, Sn, Pb, (H2), Cu, Ag, Pt, Au.
Щелочные (Li, Na, K, Rb, Cs) и щёлочноземельные металлы (Ca, Sr, Ва) реагируют с растворами солей иначе. Сначала щелочной или щёлочноземельный металл реагирует с водой раствора соли:
2Na + 2H2O = 2NaOH + H2↑
Образовавшаяся щёлочь реагирует с раствором соли:
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4
2OH– + Cu2+ = Cu(OH)2↓
Так как в ходе первой реакции выделяется достаточное количество тепла, гидроксид меди (II) разлагается (свойство нерастворимых гидроксидов):
Cu(OH)2 = CuO + H2O
Поэтому вместо меди в такой реакции образуется смесь её оксида и гидроксида.
- Растворы солей реагируют со щелочами (см. конспект по химии «Неорганические основания»).
- Соли реагируют с кислотами (см. конспект по химии «Неорганические кислоты»).
- Растворы солей реагируют друг с другом, если в результате реакции выпадает осадок (образуется нерастворимая соль):
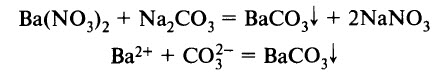
- Некоторые соли разлагаются при нагревании. Как правило, при нагревании разлагаются соли летучих кислот. Например, карбонаты (кроме карбонатов щелочных металлов) разлагаются с образованием углекислого газа и оксида металла:
![]()
Разложение нитратов при нагревании рассмотрено в конспекте «Нитраты».
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
- Реакция взаимодействия оснований с кислотами:
Mg(OH)2 + H2SO4 = MgSO4 + 2H2O
- Реакция основного оксида и кислоты:
MgO + H2SO4 = MgSO4 + H2O
- Реакция основания с кислотным оксидом:
Mg(OH)2 + SO3 = MgSO4 + H2O
- Реакция основного и кислотного оксида друг с другом:
MgO + SO3 = MgSO4
- Реакция металла с неметаллом (получение солей бескислородных кислот):
![]()
- Получение одних солей из других:
а) по реакции замещения:
Mg + H2SO4 = MgSO4 + H2↑
Mg + CuSO4 = MgSO4 + Cu
б) по реакции обмена (см. взаимодействие солей друг с другом):
MgI2 + HgSO4 = MgSO4 + HgI2↓
ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
- Неполная нейтрализация двухосновных, трёхосновных, многоосновных кислот основаниями:
2NaOH + H3РO4 = Na2HPO4 + 2H2O
(в результате неполной нейтрализации образовался гидрофосфат натрия);
NaOH + H3РO4 = NaH2PO4 + H2O
(в результате неполной нейтрализации образуется дигидрофосфат натрия).
- Неполная нейтрализация кислотных оксидов, соответствующих двухосновным, трёхосновным, многоосновным кислотам, основаниями (так можно получить только соли кислородсодержащих кислот):
4NaOH + Р2O5 = 2Na2HPO4 + H2O
(в результате неполной нейтрализации образовался дигидрофосфат натрия);
2NaOH + Р2O5 + H2O = 2NaH2PO4
(в результате неполной нейтрализации образовался гидрофосфат натрия).
- Взаимодействие средних солей с соответствующими кислотами:
Na2SO4 + H2SO4 = 2NaHSO4
NaCl (тв.) + H2SO4 (конц.) = NaHSO4 + HCl↑
- Взаимодействие средних солей с оксидами, соответствующими многоосновным кислотам, в водных растворах:
СаСO3 + СO2 + H2O = Са(НСО3)2
(в данном примере взвесь СаСO3 постепенно исчезает, так как образуется хорошо растворимый гидрокарбонат кальция).
Кислые соли, как правило, растворимы лучше соответствующих им средних. Так, например, гидрокарбонат кальция Са(НСО3)2 растворим в воде, в то время как карбонат кальция практически нерастворим.
- Кислые соли нестабильных кислот разлагаются при нагревании с образованием средних солей:
![]()
- Кислую соль можно перевести в среднюю, обработав её эквивалентным количеством щёлочи:
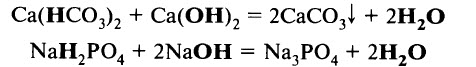
- Кислые соли вступают в такие же реакции, как и средние, например в обменные реакции солей друг с другом:
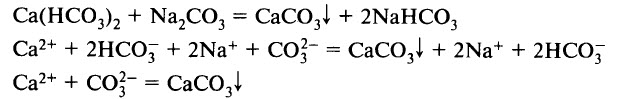
Образец выполнения задания ОГЭ
Задание. И сульфат меди (II), и нитрат серебра взаимодействуют
- 1) с хлоридом калия
- 2) с соляной кислотой
- 3) с оксидом магния
- 4) с железом
Решение. Хлорид калия, сульфат меди (II), нитрат серебра – соли. Растворимые соли взаимодействуют друг с другом, если в результате реакции один из продуктов реакции выпадает в осадок (т. е. образуется малорастворимое в воде вещество). В случае взаимодействия нитрата серебра с хлоридом калия действительно образуется осадок (белый творожистый осадок хлорида серебра):
AgNO3 + КCl = AgCl↓ + KNO3
Но сульфат меди (II) с хлоридом калия не взаимодействует, в данном случае связывания ионов в растворе не происходит. Таким образом, вариант 1 не подходит.
Соляная кислота – сильный электролит. Сильные кислоты взаимодействуют с солями слабых кислот, вытесняя их из солей. Но сульфат меди (II) – соль сильной серной кислоты, а нитрат серебра – соль сильной азотной кислоты. Серная кислота может вытеснить азотную и соляную кислоты из кристаллических солей (не в растворах), так как HNO3 и НCl – летучие кислоты, а серная – нелетучая. Соляная кислота вытеснить серную или азотную не может. Поэтому вариант 2 не подходит.
С оксидами соли взаимодействуют в редких случаях. Например, карбонаты при сплавлении взаимодействуют с оксидом кремния (IV). Средние соли при взаимодействии в растворе с кислотными оксидами соответствующих кислот превращаются в кислые соли (если такие для данных кислот существуют). В данном примере оксид магния не взаимодействует ни с сульфатом меди (II), ни с нитратом серебра. Ответ 3 не подходит.
Обе соли взаимодействуют с железом. Железо находится в электрохимическом ряду напряжений металлов до меди и до серебра:
Fe + CuSO4 = FeSO4 + Cu
Fe + 2AgNO3 = Fe(NO3)2 + 2Ag
Правильный ответ – 4 (с железом).
Всё о соли кратко в одной таблице
Конспект урока «Соли: классификация, свойства, получение».
Следующая тема: «».