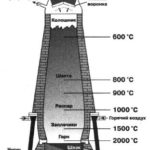
Соединения железа
Соединения железа
Ключевые слова конспекта: соединения железа (II), cоединения железа (III), железный купорос, соль Мора, гидрооксид железа, ферриты, оксид железа, полигидрат оксида.
СОЕДИНЕНИЯ ЖЕЛЕЗА (II)
Наиболее распространёнными соединениями железа (II) являются его соли:
- FeSO4 7H2O – сульфат железа (II) гептагидрат – железный купорос;
- FeSO4 (NH4)2SO4 • 6H2O – сульфат диаммония – железа (II) гексагидрат, соль Мора;
- FeCl2 4H2O – хлорид железа (II) тетрагидрат.
Гидратированные соли железа (II) обычно имеют бледно–зелёную окраску, безводные – бесцветны. Соли железа (II) чаще всего получают при взаимодействии железа с кислотами:
Fe + 2НCl = FeCl2 + H2↑
или в результате восстановления соединений железа (III):![]()
Соединения железа (II) обладают хорошей восстановительной способностью, поэтому они удобны для использования в этом качестве в водных растворах.
Гидроксид железа (II) Fe(OH)2– белое (иногда с зеленоватым оттенком), нерастворимое в воде вещество. Легко окисляется на воздухе, особенно в присутствии влаги: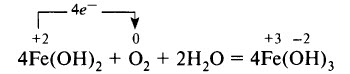
Хотя гидроксид железа (II) и проявляет амфотерные свойства, основные свойства существенно преобладают. Так, гидроксид железа (III) реагирует с кислотами:
Fe(OH)2 + 2Н+ → Fe2+ + 2H2O
СОЕДИНЕНИЯ ЖЕЛЕЗА (III)
Соединения железа (III) получают действием сильных окислителей на металлическое железо или на соединения железа (II):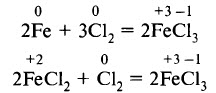
Соли железа (III) могут выступать в роли окислителей. Например:![]()
Одной из качественных реакций на ион Fe3+ является взаимодействие с роданидом калия (натрия, аммония). Признаком реакции служит образование кроваво–красного раствора роданида железа (III):![]()
Оксид железа (III) Fe2O3 – красно-коричневый или тёмно-коричневый порошок. Оксид железа (III) хотя и проявляет амфотерность и реагирует с кислотами, а со щелочами реагирует при сплавлении:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
В результате реакции образуются ферриты. Они также образуются при сплавлении с основными оксидами или карбонатами щелочных металлов:![]()
Оксид железа (III) получают прокаливанием гидроксида или нитрата железа (III):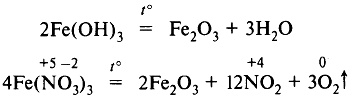
Гидроксид железа (III) Fe(OH)3. Формула Fe(OH)3 употребляется условно. Существует полигидрат оксида железа (III) Fe2O3 • nH2O.
Полигидрат оксида железа (III) – осадок бурого цвета, выпадает при действии щелочей или водного раствора аммиака на растворы, содержащие Fe3+:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Fe3+ + 3ОН– = Fe(OH)3↓
Гидроксид железа (III) – это слабое основание, его амфотерные свойства проявляются только при сплавлении со щелочами и основными оксидами, при этом образуются ферриты. Под действием воды ферриты полностью гидролизуются:
NaFeO2 + 2H2O = Fe (ОН)3↓ + NaOH
Конспект урока по химии «Соединения железа». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии