Ортофосфорная кислота. Фосфаты
Ортофосфорная кислота. Фосфаты
Ключевые слова конспекта: ортофосфорная кислота, фосфаты
Высшими гидроксидами фосфора являются фосфорные кислоты: ортофосфорная H3РO4, метафосфорная НРО3 и дифосфорная Н4Р2O7.
Ортофосфорная кислота – вещество молекулярного строения. В безводном состоянии образует бесцветные гигроскопичные легкоплавкие (t°пл = 42 °С) кристаллы. Смешивается с водой в любых соотношениях.
Ортофосфорная кислота – слабый электролит, диссоциирует ступенчато:
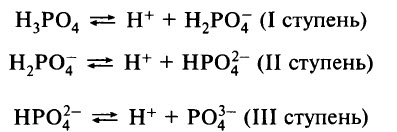
Ортофосфорная кислота проявляет общие свойства кислот. Она взаимодействует:
- а) с основаниями:
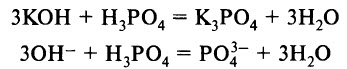
- б) с основными и амфотерными оксидами:
![]()
- в) с солями более слабых и летучих кислот:
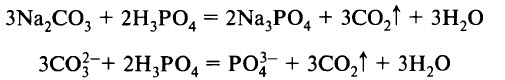
В отличие от азотной кислоты, ортофосфорная может образовать кислые соли:
2КОН + H3РO4 = К2НРO4 + 2H2O
или
КОН + H3РO4 = КH2РO4 + H2O
Окислительные свойства осуществляются только за счёт иона водорода. Однако реакции со многими металлами замедляются из-за образования нерастворимых фосфатов. Например, магний реагирует с фосфорной кислотой, но скорость реакции постепенно уменьшается вследствие образования нерастворимого фосфата на поверхности магния:![]()
При нагревании ортофосфорная кислота теряет воду, превращаясь в дифосфорную кислоту, а затем в полифосфорные кислоты:
2H3РO4 = Н4Р2O7 + H2O
ФОСФАТЫ
Ортофосфорная кислота – трёхосновная, образует три ряда солей: средние – фосфаты Xn(PO4)m (X – катион металла), кислые – гидроортофосфаты Xn(HPO4)m (X – катион металла или NH4+) и дигидроортофосфаты Х(H2РO4)n (X – катион металла или NH4+, n = 1; 2).
Фосфаты – вещества с ионным типом кристаллических решёток, при обычных условиях – твёрдые кристаллические вещества. Фосфаты могут быть окрашены только за счёт катионов металлов. Средние фосфаты плохо растворимы в воде (растворимы только фосфаты Na, К, Rb, Cs), гидрофосфаты и особенно дигидрофосфаты гораздо лучше растворимы в воде. Средние ортофосфаты плавятся без разложения при нагревании при достаточно высоких температурах.
В водных растворах средних фосфатов обязательно происходит гидролиз:
![]()
Поэтому водные растворы средних фосфатов имеют щелочную реакцию.
Для фосфатов, в отличие от нитратов, не характерны окислительные свойства, несмотря на то что фосфор находится в высшей степени окисления. Этому способствует симметричная тетраэдрическая структура иона РО43–.
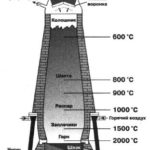
Однако восстановление фосфора в высшей степени окисления +5 возможно. Примером такой реакции может служить промышленное получение фосфора:
![]()
Одной из качественных реакций на фосфаты является образование жёлтого осадка при взаимодействии с растворимыми солями серебра:
![]()
Конспект урока химии «Ортофосфорная кислота. Фосфаты».
Следующая тема: «».