Оксиды углерода
Оксиды углерода
Ключевые слова конспекта: оксиды углерода, угарный газ, монооксид углерода, формиаты, газообразное топливо, газогенераторы, генераторный газ, углекислый газ, диоксид углерода,
Углерод образует два устойчивых оксида – оксид углерода (II) СО (монооксид углерода) и оксид углерода (IV) СO2 (диоксид углерода).
Оксид углерода (II) — угарный газ
Оксид углерода (II) (монооксид углерода, угарный газ СО) – вещество молекулярного строения. В молекуле СО связь ковалентная полярная, тройная. Две общие электронные пары образованы по обменному механизму, одна – по донорно-акцепторному: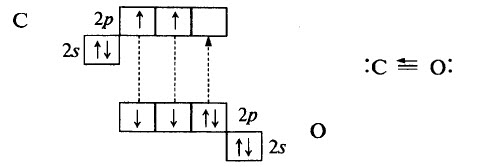
Тройная связь в молекуле СО очень прочная, её энергия больше, чем в молекуле N2 (1069 кДж/моль в молекуле СО, 946 кДж/моль в молекуле N2).
При обычных условиях оксид углерода (II) – газ без цвета, без запаха, чуть легче воздуха, плохо растворяется в воде и с ней не взаимодействует, сжижается при –191,5 °С, затвердевает при –205 °С.
Оксид углерода (II) – несолеобразующий оксид, при обычных условиях не взаимодействует ни с кислотами, ни со щелочами, но при нагревании под давлением реакция со щёлочью становится возможной, продуктами реакции являются формиаты – соли муравьиной кислоты: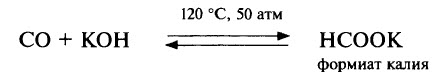
Оксид углерода (II) обладает ярко выраженными восстановительными свойствами за счёт углерода в промежуточной степени окисления +2. Восстановительные свойства оксида углерода (II) в обычных условиях выражены сильнее, чем у водорода. При нагревании он восстанавливает некоторые металлы из их оксидов: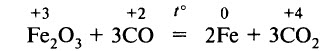
На этом основана, например, выплавка чугуна из железных руд в домне.
Оксид углерода (II) горит в кислороде и образует с ним взрывчатые смеси (воспламенение происходит только при t° = 700 °С):
2СО + O2 = 2СO2
Оксид углерода (II) в лаборатории получают при нагревании смеси муравьиной кислоты и серной концентрированной. Серная кислота выступает в роли водоотнимающего (дегидратирующего) реагента:
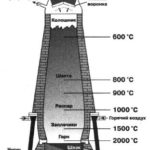
Оксид углерода (II) имеет большое значение как составная часть газообразного топлива – воздушного, водяного или смешанного газа. Воздушный газ получают продуванием воздуха через раскалённый уголь в специальных цилиндрических печах – газогенераторах. Сверху в генератор загружают уголь, а снизу подают воздух. При горении угля в нижней зоне происходит полное окисление углерода:
С + O2 = СO2
Образующийся в нижней части генератора углекислый газ поднимается вверх и, проходя через раскалённые слои угля, взаимодействует с ним:![]()
Образующийся оксид углерода (II) вместе с азотом воздуха выходит из генератора. Смесь этих газов в соотношении 1 : 2 (по объёму) называют генераторным газом.
Водяной газ получают путём пропускания водяных паров через раскалённый уголь (t° = 800– 1000 °С):![]()
Оксид углерода (II) крайне токсичен, он связывается с гемоглобином крови, образуя очень прочный комплекс карбоксигемоглобина. Такой гемоглобин уже не может переносить кислород.
Оксид углерода (IV) — углекислый газ
Оксид углерода (IV) (диоксид углерода, углекислый газ СO2) – вещество молекулярного строения. В молекуле СO2 связи ковалентные полярные, двойные:![]()
При обычных условиях оксид углерода (IV) – газ без цвета, без запаха, значительно тяжелее воздуха, растворим в воде. Твёрдый СO2 при t°= –78 °С возгоняется без плавления.
Оксид углерода (IV) – кислотный оксид, но только небольшая часть растворённого СO2 (менее 1%) взаимодействует с водой с образованием угольной кислоты:
СO2 + H2O ⇆ H2CO3
Оксид углерода (IV) взаимодействует со щелочами:![]()
Оксид углерода (IV) взаимодействует с оксидами щелочных и щёлочноземельных металлов и магния:
MgO + СO2 = MgCO3
Качественной реакцией на углекислый газ является помутнение известковой воды – раствора гидроксида кальция:
Са(ОН)2 + СO2 = СаСO3↓ + H2O
При пропускании избытка углекислого газа помутнение исчезает:
СаСО3 + СO2 + H2O = Са(НСО3)2
В оксиде углерода (IV) содержится углерод в высшей степени окисления, следовательно, он может выступать в роли окислителя. Однако окислительные свойства для оксида углерода (IV) не характерны. Например, горящий магний продолжает гореть в углекислом газе:![]()
В лаборатории оксид углерода (IV) получают взаимодействием карбонатов с сильными кислотами. Чаще всего кусочки мрамора СаСО3 обрабатывают соляной кислотой:
СаСО3 + 2HCl = СаCl2 + CO2↑ + H2O
Конспект урока по химии «Оксиды углерода». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
Ещё конспекты по теме «Углерод и кремний«: