Валентность химических элементов
Валентность химических элементов
В образовании новых химических связей участвуют неспаренные электроны внешнего энергетического уровня. Именно они, как правило, определяют валентностъ элемента.
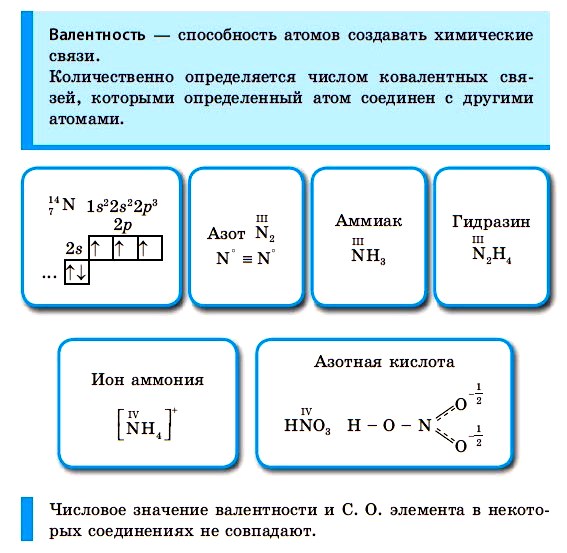
■ Валентность — это способность атомов химических элементов образовывать химические связи с другими атомами.

Валентность выражается числом атомов одновалентных элементов, которое атом данного элемента может замещать или присоединять во время образования определенного химического соединения. Валентность — свойство элемента, проявляемое в соединениях. Валентность обозначают римскими цифрами, она может составлять от I до VIII.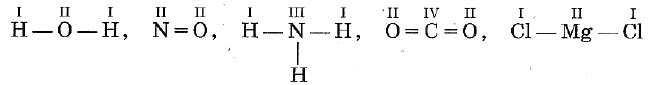
Существуют одновалентные (Н, Li, Na, K, F, Br), двухвалентные (Mg, Ca, Ba, O, S), трехвалентные (Al, N, P), четырехвалентные (C, Si) и т. п. элементы. Понятно, что один атом двухвалентного элемента соединяется с двумя атомами одновалентного элемента (CaCl2, Н2О), но с одним атомом двухвалентного атома (CaO). Атом трехвалентного элемента соединяется с тремя атомами одновалентного элемента FeCl3), два атома — трехвалентного (AlN).
Существуют атомы, имеющие постоянную (Na, K, Ca, Al, О) и переменную валентности. Например, валентность серы бывает II, IV и VI:![]()
Рассмотрев электронно-графические формулы элементов, можно определить, что валeнтность атома водорода равна I (имеет один неспаренный электрон). По одному неспаренному электрону у лития, фтора, натрия, калия. Эти атомы тоже одновалентны. Магний двухвалентен, т. к. у него два неспаренных электрона. У атомов гелия, неона и аргона все электроны спарены и отсутствуют свободные орбитали. Эти элементы химически инертны, то есть обладают нулевой валентностью.
Однако химические элементы в соединениях далеко не всегда проявляют валентность, соответствующую количеству неспаренных электронов в основном состоянии атома. Например, углерод может проявлять валентность IV (CO2).
Возможность проявлять ту или иную валентность зависит также и от количества свободных орбиталей на внешнем электронном слое атома: при наличии незанятых электронами р-орбиталей один из спаренных s-электронов может переходить на свободную р-орбиталь (при условии получения определенной порции дополнительной энергии извне).
Состояние атома, при котором электроны переходят с одной орбитали на другую в пределах одного энергетического уровня, называется возбужденным.
Пример. Рассмотрим атом углерода в основном и возбужденном состояниях (значком * обозначается возбужденное состояние атома):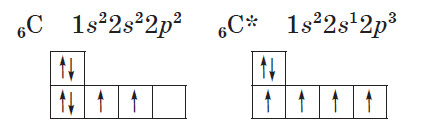
В основном состоянии атом углерода имеет два неспаренных электрона на р-подуровне; при переходе атома в возбужденное состояние один из двух электронов s-подуровня может переходить на свободную р-орбиталь. Количество неспаренных электронов в возбужденном состоянии увеличится до четырех. Валентность углерода при этом также изменится с двух до четырех.
Если в атомах нет свободных орбиталей (например, у кислорода или фтора), то разъединить электронные пары в этом случае невозможно. Поэтому вaлентность этих элементов будет совпадать с количеством неспаренных электронов: кислород двухвалентен, фтор одновалентен.
Конспект урока «Валентность химических элементов».
Следующая тема: «Определение валентности + Примеры»