Состав атомного ядра. Изотопы
Состав атомного ядра. Изотопы
Раздел ОГЭ по физике: 4.3. Состав атомного ядра. Изотопы.
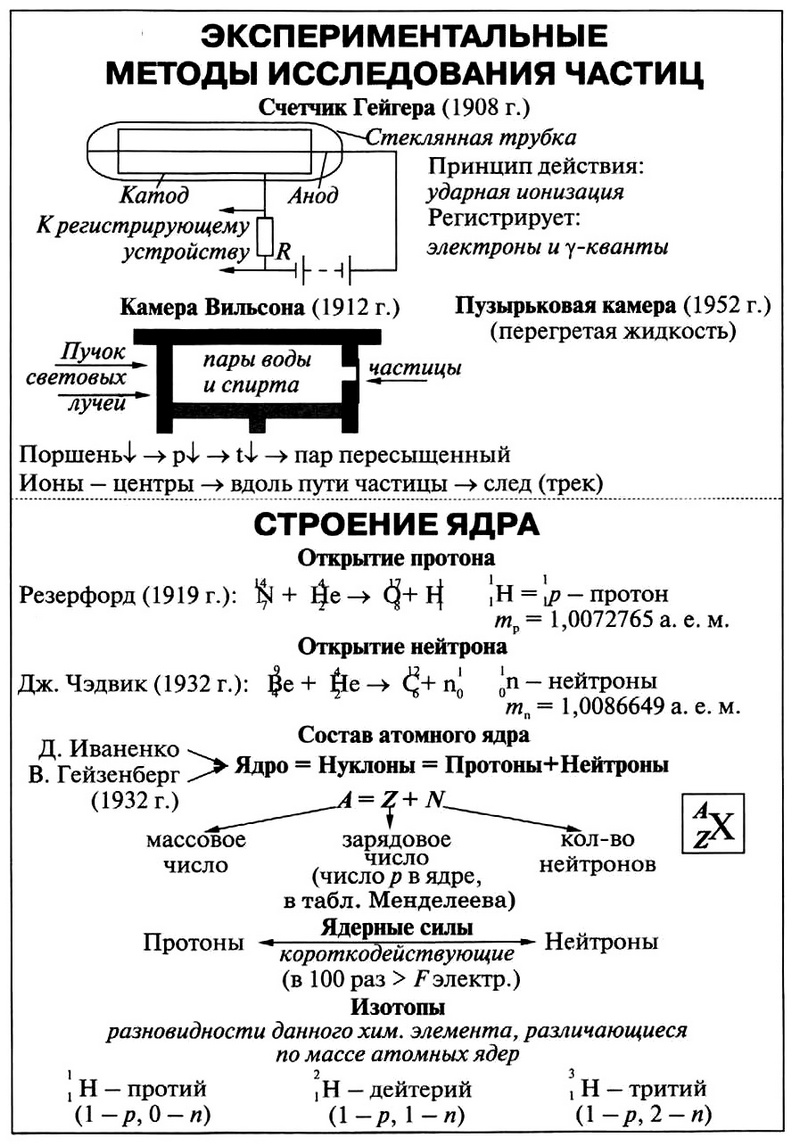
Экспериментальное изучение строения атомного ядра осуществлял Резерфорд. Он облучал β-частицами атомы азота и других элементов.
Ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов. Протоны и нейтроны называются нуклонами. Число нуклонов в ядре называется массовым числом.
Заряд ядра кратен элементарному электрическому заряду Q = Ze. Число Z называется зарядовым числом, оно совпадает с номером элемента в периодической системе элементов Менделеева. Число нейтронов N равно разности массового и зарядового чисел: N = A – Z.
То, что ядра химических элементов устойчивы, нельзя объяснить гравитационным взаимодействием нуклонов:
- оно слишком мало, поскольку мала масса нуклонов;
- электромагнитное взаимодействие между этими частицами отсутствует, так как нейтрон не имеет электрического заряда.
Соответственно, между нуклонами в ядре действуют силы другой природы. Их называют ядерными силами, они характеризуют взаимодействие, называемое сильным. Ядерное взаимодействие очень сильное, но существует на малых расстояниях.
Ядро химического элемента обозначается как ![]() , где X – символ химического элемента. Например,
, где X – символ химического элемента. Например,![]()
Например: в ядре атома лития ![]() содержится: протонов Z = 3 и нейтронов N = А — Z = 4.
содержится: протонов Z = 3 и нейтронов N = А — Z = 4.
Ядра одного и того же химического элемента могут содержать разное число нейтронов. При этом они имеют одинаковое зарядовое число, но разное массовое число. Например, ядра ![]() и
и ![]() имеют по 143 и 146 нейтронов соответственно. Ядра с одинаковым числом протонов, но различным числом нейтронов являются ядрами одного и того же химического элемента и называются изотопами.
имеют по 143 и 146 нейтронов соответственно. Ядра с одинаковым числом протонов, но различным числом нейтронов являются ядрами одного и того же химического элемента и называются изотопами.
Изотопы имеют одинаковые химические свойства, что обусловлено одинаковым электрическим зарядом ядра, но разные физические свойства.
Конспект урока «Состав атомного ядра. Изотопы».
Следующая тема: «Ядерные реакции. Ядерный реактор».
