Реакции ионного обмена. Ионное уравнение
Реакции ионного обмена. Ионное уравнение
Ключевые слова конспекта: свойства ионов, определение ионов, реакции ионного обмена, ионное уравнение, реакции в растворах электролитов.
Свойства ионов
Число электронов в атоме равно числу протонов. Протоны и нейтроны прочно связаны друг с другом и образуют ядро атома. Ион – атом или часть молекулы, где есть неравное количество электронов и протонов. Если электронов больше, чем протонов, то ион называют отрицательным. Иначе ион называют положительным.
Ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из ионов характерны специфические химические свойства.
Таблица 1. Определение ионов
|
Определяемый ион |
Реактив, содержащий ион |
Результат реакции |
| Н+ | Индикаторы | Изменение окраски |
| Ag+ | Cl– | Белый осадок |
| Cu2+ | OH– | Синий осадок |
| S2– | Черный осадок Окрашивание пламени в сине-зеленый цвет | |
| Fe2+ | OH– | Зеленоватый осадок, который с течением времени буреет |
| Fe3+ | OH– | Осадок бурого цвета |
| Zn2+ | OH– | Белый осадок, при избытке ОН– растворяется |
| S2– | Белый осадок | |
| Аl3+ | OH– | Белый желеобразный осадок, который при избытке ОН– растворяется |
| NH4+ | OH– | Запах аммиака |
| Ba2+ | SO42– | Белый осадок Окрашивание пламени в желто-зеленый цвет |
| Ca2+ | CO32– | Белый осадок Окрашивание пламени в кирпично-красный цвет |
| Na+ | Цвет пламени желтый | |
| K+ | Цвет пламени фиолетовый (через кобальтовое стекло) | |
| Cl– | Ag+ | Белый осадок |
| H2SO4* | Выделение бесцветного газа с резким запахом (НСl) | |
| Br– | Ag+ | Желтоватый осадок |
| H2SO4* | Выделение SO2 и Вг2 (бурый цвет) | |
| I– | Ag+ | Желтый осадок |
| H2SO4* | Выделение H2S и I2 (фиолетовый цвет) | |
| SO32– | H+ | Выделение SO2 — газа с резким запахом, обесцвечивающего раствор фуксина и фиолетовых чернил |
| CO32– | H+ | Выделение газа без запаха, вызывающего помутнение известковой воды |
| СН3СОО– | H2SO4 | Появление запаха уксусной кислоты |
| NO3– | H2SO4(конц.) и Cu | Выделение бурого газа |
| SO42– | Ba2+ | Белый осадок |
| PO43– | Ag+ | Желтый осадок |
| OH– | Индикаторы | Изменение окраски индикаторов |
* При определении галогенид-ионов с помощью серной кислоты используют твердую соль.
Ионное уравнение
В водных растворах все электролиты в той или иной степени распадаются на ионы и реакции происходят между ионами.
Сущность реакций в растворах электролитов отражается ионным уравнением. В ионном уравнении учитывается то, что сильный электролит в растворе находится в диссоциированном виде. Формулы слабых электролитов и нерастворимых в воде веществ в ионных уравнениях принято записывать в недиссоциированной на ионы форме. Растворимость электролита в воде нельзя считать критерием его силы. Многие нерастворимые в воде соли являются сильными электролитами, однако концентрация ионов в растворе оказывается низкой вследствие низкой растворимости. Именно поэтому в уравнениях их формулы записывают в недиссоциированной форме.
При составлении ионных уравнений реакций с участием сильных кислот часто для упрощения записывают формулу иона Н+, а не H3O+.
Реакции в растворах электролитов происходят в направлении связывания ионов. Существует несколько форм связывания ионов: образование осадков, выделение газообразных веществ, образование слабых электролитов. Рассмотрим конкретные примеры:
- Образование осадков.
Уравнение в молекулярном виде: Ca(NO3)2 + Na2CO3 = СаСO3↓ + 2NaNO3
Полное ионное уравнение:![]()
Сокращенное ионное уравнение:![]()
- Выделение газов (например, СO2, SO2, H2S, NH3):
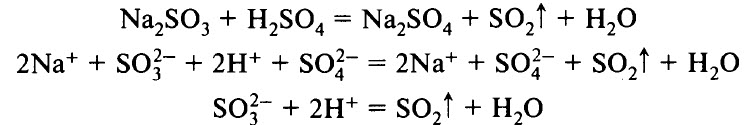
- Образование слабых электролитов (например, воды, слабых кислот):
а) КОН + НCl = КCl + H2O
К+ + OH– + Н+ + Cl– = К+ + Cl– + H2O
OH– + Н+ = H2O
б) HNO2 – азотистая кислота (слабая):
NaNO2 + НCl = NaCl + HNO2
Na+ + NO2 + Н+ + Cl– = Na+ + Cl– + HNO2
NO2– + Н+ = HNO2
Иногда реакции в растворах электролитов осуществляются с участием нерастворимых веществ или слабых электролитов в направлении более полного связывания ионов. Например, мрамор растворяется в соляной кислоте с образованием углекислого газа:
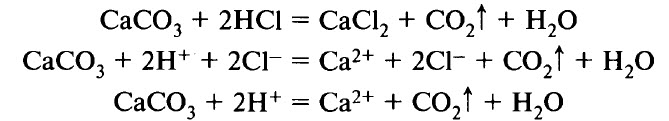
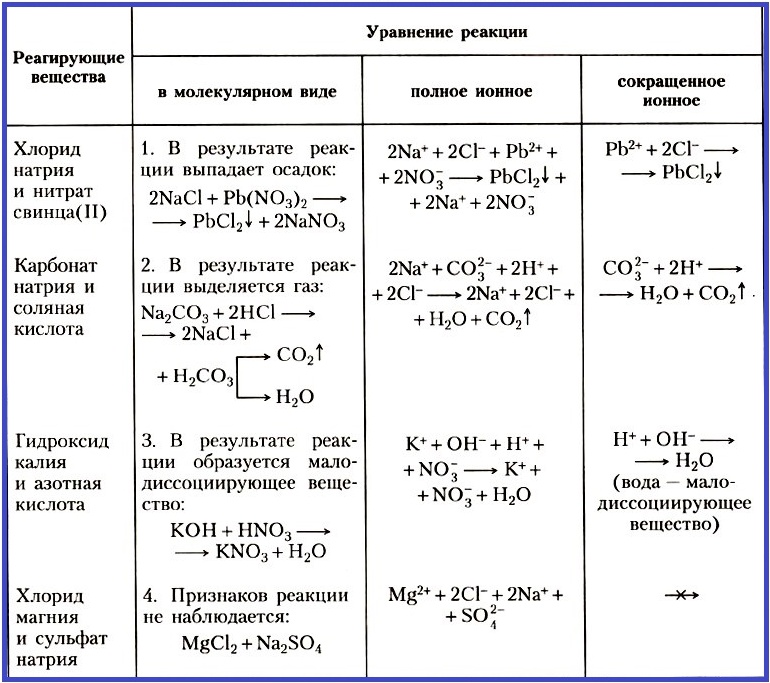
Таблица 2. Уравнения ионных реакций
Реакции ионного обмена
Для ионных реакций выражение «в молекулярном виде», как и сама запись, является условным. При анализе приведенных в Таблице 2 уравнений реакций выясняется, что реакции ионного обмена протекают до конца в следующих случаях:
- если выпадает осадок;
- если выделяется газ;
- если образуется малодиссоциирующее вещество, например вода.
Если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена не протекает до конца, т. е. является обратимой. При составлении уравнений таких реакций, как и при составлении уравнений диссоциации слабых электролитов, ставится знак обратимости.
Чтобы сделать вывод о протекании реакции ионного обмена до конца, надо использовать данные таблицы растворимости солей, оснований и кислот в воде.
Чтобы составить уравнения всех возможных реакций, в которых участвуют хлорид магния и другие растворимые в воде вещества, рассуждают так:
- Убеждаются, растворимо ли в воде взятое вещество, в данном случае хлорид магния MgCl2.
- Приходят к выводу, что хлорид магния MgCl2 будет реагировать только с такими растворимыми в воде веществами, которые способны осадить либо ионы Mg2+, либо хлорид-ионы Сl–.
- Ионы Mg2+ можно осадить: а) ионами ОН–, т. е. нужно подействовать любой щелочью, что приведет к образованию малорастворимого гидроксида магния Mg(OH)2; б) при действии растворимыми в воде солями, содержащими один из следующих анионов:
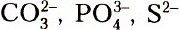 . Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде.
. Для этого можно воспользоваться солями натрия, калия и аммония, содержащими указанные анионы, так как эти соли растворимы в воде. - Хлорид-ионы Сl– можно осадить катионами Ag++ и Pb2+. Поэтому для проведения реакции нужно выбрать растворимые соли, содержащие эти катионы.
При составлении уравнений реакций ионного обмена, в которых образуются газообразные вещества, следует учесть, что анионы ![]() способны реагировать с кислотами с образованием соответствующего газа, например:
способны реагировать с кислотами с образованием соответствующего газа, например:![]()
В свете представлений об электролитической диссоциации кислот, оснований и солей общие свойства этих веществ определяются наличием общих ионов, которые входят в их состав
Конспект урока «Реакции ионного обмена. Ионное уравнение».
Следующая тема: «».