Биополимеры. Белки
Конспект урока по биологии «Биополимеры. Белки» (УМК Высоцкая, Дымшиц, Рувинский и др) в 10 классе (углубленное изучение). Основные темы: Макромолекулы. Полимеры. Мономеры. Аминокислоты. Пептидная связь. Олигопептид. Полипептид. Конформация белковой молекулы. Денатурация. .
Биополимеры. Белки
В составе клеток содержится множество органических соединений. Рассмотрим наиболее важные группы, которые определяют основные свойства клетки и организма.
БИОПОЛИМЕРЫ.
Многие органические соединения, входящие в состав клетки, характеризуются большим размером молекул. Такие молекулы называют макромолекулами (от греч. makros — большой). Они обычно состоят из остатков повторяющихся, сходных по структуре низкомолекулярных соединений, ковалентно связанных между собой. Эти соединения получили название мономеров (от греч. monos — один). Образованную мономерами макромолекулу называют полимером (от греч. polys — многочисленный). Многократно повторяющиеся группировки атомов, которые являются остатками мономеров, называют структурными звеньями. Молекулы полимеров могут иметь линейное, разветвлённое или сетчатое строение.
Если соединять мономеры двух типов — А и Б, можно получить большой набор различных полимеров. Свойства таких полимеров будут зависеть от числа, соотношения и порядка чередования структурных звеньев в цепях.
Полимер, в молекуле которого группа структурных звеньев повторяется периодически, называют регулярным. Таковы, например, схематически изображённые полимеры с закономерным чередованием звеньев:
…АБАБАБАБ…
…АББАББАББАББ…
Полимеры, в которых нет определённой закономерности в последовательности звеньев, называют нерегулярными:
…АБАААББАБББААБ…
Сочетание и перестановка нескольких типов структурных звеньев обеспечивают построение множества вариантов полимерных цепей с различными свойствами. Примером могут служить молекулы нуклеиновых кислот и белков.
БЕЛКИ.
После удаления воды из клетки в сухом остатке на первом месте по содержанию стоят белки. Они составляют 10—20% от сырой массы и 50—80% от сухой массы клетки. Белки называют также протеинами (от греч. protos — первый, главный). Этим названием хотели подчеркнуть первостепенное значение белков для жизненного процесса.
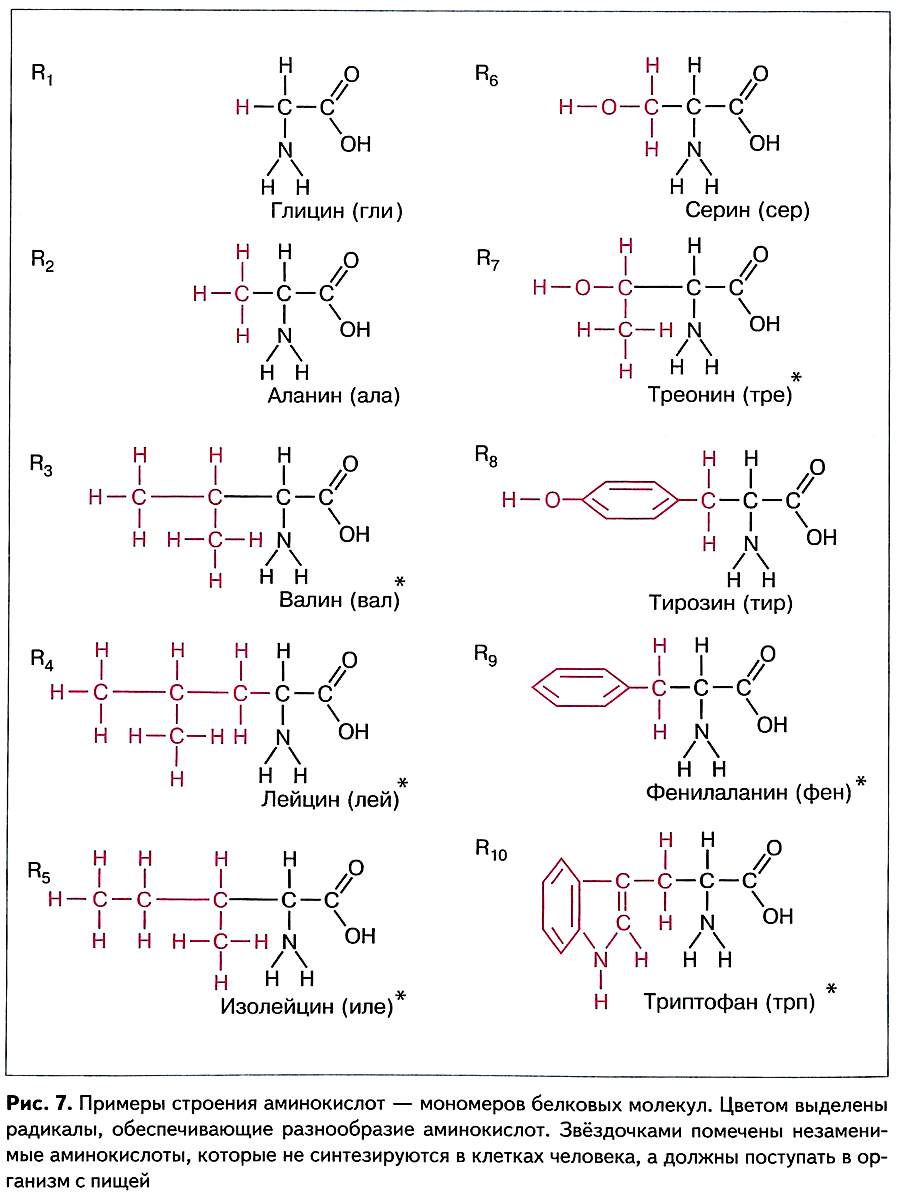
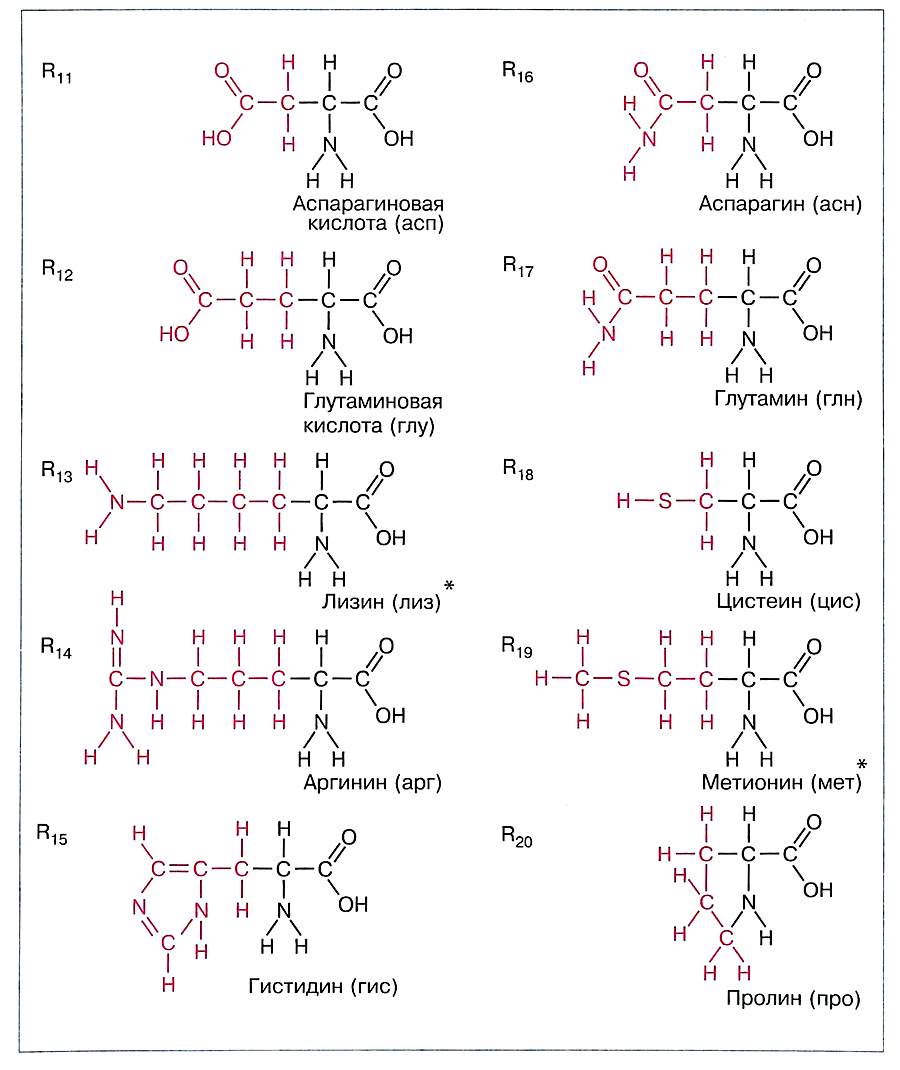
Белки — это линейные нерегулярные полимеры, мономерами которых являются аминокислоты. В состав большинства белков входят остатки 20 разных аминокислот (рис. 7).
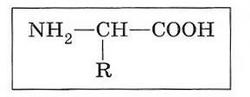
Молекула каждой аминокислоты содержит две функциональные группы (аминогруппу — NH2 и карбоксильную группу — СООН), а также радикал (R) — группировку атомов, по которой аминокислоты отличаются друг от друга (строго говоря, пролин является иминокислотой, так как вместо аминогруппы содержит иминогруппу —NH—.):
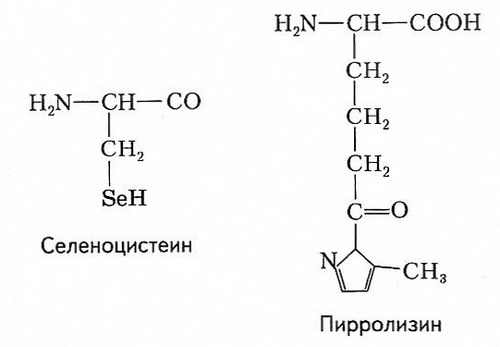
Кроме приведённых на рисунке 7 канонических аминокислот, т. е. кодируемых значащими триплетами генетического кода, существуют две неканонические аминокислоты — селеноцистеин и пирролизин.
Эти аминокислоты кодируются по–другому и включаются в небольшое число белков. Селеноцистеин встречается у всех живых организмов; он входит в состав белков, обладающих каталитической или антиоксидантной активностью. Пирролизин характерен только для пяти видов архей и одной эубактерии.
В цитоплазме находятся свободные аминокислоты, составляющие аминокислотный фонд, за счёт которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления ферментами запасных белков и белков пищи.
Соединение аминокислот происходит через общие для них группировки: аминогруппа одной аминокислоты взаимодействует с карбоксильной группой другой аминокислоты, при этом отщепляется молекула воды. Между соединившимися аминокислотами возникает ковалентная связь, называемая пептидной связью:
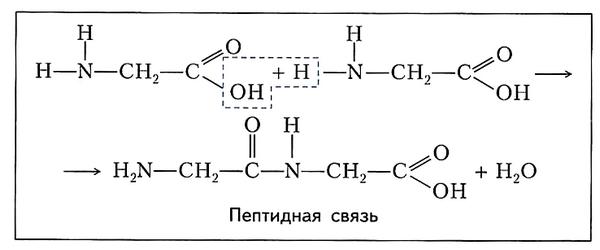
Образовавшееся соединение нескольких аминокислот (от двух до двадцати) называют олигопептидом (или просто пептидом). Соединение из большего числа аминокислот называют полипептидом.
Макромолекулы белков характеризуются большой молекулярной массой. Так, молекулярная масса инсулина (гормона поджелудочной железы быка) — 5733, белка–фермента рибонуклеазы из поджелудочной железы быка — 13 683, протеолитического фермента химотрипсина из того же органа — 22 600, гемоглобина человека — 64 500. В состав большинства белков входит 300—500 аминокислотных остатков, но есть и более крупные белки (7500 и более аминокислотных остатков).
При установлении структуры белка определяют, какие из 20 аминокислот входят в его состав. Оказалось, что такие белки, как казеин молока, миозин мышц, альбумин яйца, содержат все 20 аминокислот, в рибонуклеазе их 19, в инсулине — 18, а в сальмине (белок из молок рыб) — всего 7.
Белки различаются и составом аминокислот, и числом аминокислотных звеньев, и особенно порядком чередования их в полипептидной цепи. Расчёт показывает, что для белка, построенного из 20 различных аминокислот и содержащего в цепи 100 аминокислотных остатков, число возможных вариантов может составлять 20100.
В состав белков включаются только левовращающие L–стереоизомеры аминокислот. D–аминокислоты в свободной форме могут присутствовать в клетке, но в белки не включаются.
Если учесть, что размер каждой аминокислоты около 0,3 нм, то белок, составленный из многих аминокислотных остатков, должен представлять собой длинную нить. Изучение белков в растворах показало, что макромолекулы белков имеют форму компактных шаров (глобул) или вытянутых структур (фибрилл). Следовательно, полипептидная цепь каким–то образом сплетается, образуя клубок или пучок нитей.
Исследования показали, что в укладке полипептидной цепи нет ничего случайного или хаотичного. Она свёртывается упорядоченно, определённым образом для каждого белка.
УРОВНИ ОРГАНИЗАЦИИ БЕЛКОВОЙ МОЛЕКУЛЫ.
Пространственное расположение атомов в молекуле называют конформацией. Для того чтобы разобраться в замысловатой укладке (архитектонике) белковой макромолекулы, следует рассмотреть несколько уровней её организации.
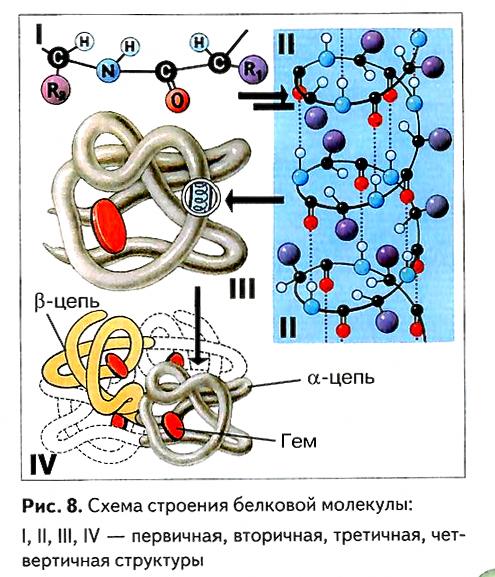 Первичной структурой, самой простой, является полипептидная цепь, т. е. последовательность аминокислот, связанных между собой пептидными связями. В первичной структуре все связи между аминокислотами являются ковалентными и, следовательно, прочными (рис. 8).
Первичной структурой, самой простой, является полипептидная цепь, т. е. последовательность аминокислот, связанных между собой пептидными связями. В первичной структуре все связи между аминокислотами являются ковалентными и, следовательно, прочными (рис. 8).
Следующий, более высокий уровень организации — это вторичная структура. При её образовании белковая нить обычно закручивается в виде спирали. Между кислородами групп С=O, находящихся на одном витке спирали, и водородами групп N—Н на другом витке образуются водородные связи (рис. 8).
Водородные связи слабее ковалентных, но при большом их числе обеспечивают поддержание прочной структуры. В одном витке регулярной спирали умещается 3,6 аминокислотного остатка. Группа N—Н n-го аминокислотного остатка взаимодействует с группой С=О (n—4)-го остатка. В определённых случаях спиральная укладка нарушается. Это происходит в местах расположения пролина (из–за отсутствия группы N—Н) или находящихся рядом друг с другом одинаково заряженных радикалов (из–за их отталкивания). Водородные связи при этом образуются между остатками аминокислот, находящихся на разных расстояниях друг от друга, что приводит к складыванию полипептида «в гармошку». В молекулах большинства белков есть как спиральные, так и складчатые участки. Складки могут как образовываться внутри одного полипептида, так и формировать слои между рядом расположенными полипептидами.
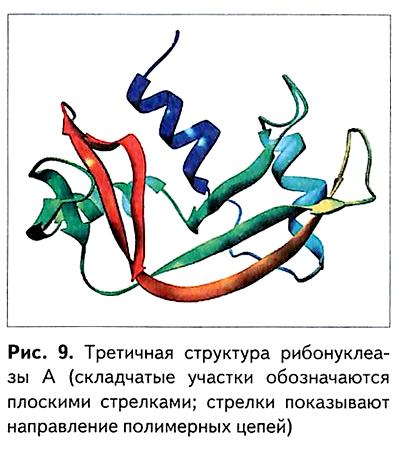 В водной среде полипептидная цепь далее свёртывается, образуя или клубок (глобулу), или нить (фибриллу). Возникает сложная пространственная структура (конформация), называемая третичной структурой (рис. 8, 9).
В водной среде полипептидная цепь далее свёртывается, образуя или клубок (глобулу), или нить (фибриллу). Возникает сложная пространственная структура (конформация), называемая третичной структурой (рис. 8, 9).
Определение третичной структуры производят с помощью рентгеноструктурного анализа, который позволяет установить положение в пространстве атомов и групп атомов в соединениях.
Связи, поддерживающие третичную структуру белка, также слабые. Они возникают, в частности, вследствие гидрофобных взаимодействий. Это силы притяжения между неполярными молекулами или между неполярными участками молекул в водной среде. Гидрофобные радикалы некоторых аминокислот в водном растворе сближаются, «слипаются» и стабилизируют таким образом структуру белка. Кроме гидрофобных сил, в поддержании третичной структуры белка существенную роль играют электростатические связи между электроотрицательными и электроположительными радикалами аминокислотных остатков. Третичная структура поддерживается также небольшим числом ковалентных дисульфидных связей (S—S), возникающих между атомами серы цистеиновых радикалов. Стабилизация третичной структуры зависит и от водородных связей между гидроксильными группами серина, треонина и тирозина и атомом азота в радикале гистидина или атомом кислорода в радикалах аспарагиновой и глутаминовой кислот. Подавляющее большинство глобулярных белков (имеющих третичную структуру в форме глобулы) растворимо в водной среде. Гидрофобное «ядро» таких белков прячется в гидрофильной «оболочке», обеспечивающей их растворимость.
Надо сказать, что и третичная структура белка не всегда является конечной. Четвертичную структуру имеют белки, образующиеся при соединении нескольких молекул полипептидов в единый белковый комплекс (см. рис. 8). Такие белки, состоящие из нескольких отдельных цепочек, часто не связанных друг с другом ковалентными связями, тем не менее считаются одной молекулой. Для белков, не имеющих четвертичной структуры, названия «белок» и «полипептид» являются синонимами. Другими словами, белком можно назвать как отдельный полипептид, так и агрегат из нескольких полипептидных цепей, если они выполняют определённую биологическую функцию. Например, сложная молекула гемоглобина — глобулярного белка, находящегося в эритроцитах, состоит из четырёх полипептидов: двух a-цепей и двух β-цепей, каждая из которых соединена с железосодержащим гемом (гем – особая пигментная группа, содержащая железо).
В результате их объединения образуется функционирующая молекула гемоглобина. Только в такой упаковке гемоглобин работает полноценно, т. е. способен переносить кислород и углекислый газ. А четвертичную структуру нерастворимого фибриллярного белка кератина (основного компонента волос, шерсти, перьев, ногтей, рогов, копыт) образуют несколько вытянутых полипептидных цепей, соединённых ковалентными связями между радикалами цистеина. Каждый волос млекопитающих состоит из «трёхжильных канатов», скрученных из цепочек богатого цистеином a-кератина. Цепочки скреплены друг с другом дисульфидными связями.
Начиная с вторичной структуры пространственное устройство (конформация) макромолекул белка, как мы выяснили, поддерживается в основном слабыми химическими связями. Под влиянием внешних факторов (изменение температуры, солевого состава среды, pH, действие радиации и др.) слабые связи, стабилизирующие макромолекулу, рвутся, и структура белка, а следовательно, и его свойства изменяются. Этот процесс называют денатурацией.
Подавляющее большинство белков утрачивает при этом биологическую активность, хотя первичная структура их после денатурации не меняется. Дело в том, что в процессе денатурации нарушаются вторичная, третичная и четвертичная структуры, обусловленные слабыми взаимодействиями между аминокислотными остатками, а ковалентные пептидные связи не разрываются. Необратимую денатурацию можно наблюдать при нагревании жидкого и прозрачного белка куриного яйца: он становится плотным и непрозрачным.
Денатурация может быть и обратимой. После устранения денатурирующего фактора многие белки способны вернуть естественную форму, т. е. ренатурировать.
Иногда денатурация белка имеет биологический смысл. Например, паук выделяет капельку секрета и приклеивает её к какой-нибудь опоре. Затем, продолжая выделять секрет, он слегка натягивает ниточку, и этого слабого натяжения оказывается достаточно, чтобы белок денатурировался (из растворимой формы перешёл в нерастворимую) и нить приобрела прочность.
Разрыв части слабых связей, изменение конформации и свойств белка происходят и под действием физиологических факторов (например, под действием гормонов). Таким образом регулируются функции белков: ферментов, рецепторов, переносчиков. Эти изменения структуры белка обычно обратимы.
Способность белков к обратимому изменению пространственной структуры в ответ на действие физических или химических факторов лежит в основе раздражимости — важнейшего свойства всех живых существ.
Вопросы и упражнения
- Приведите примеры регулярных и нерегулярных полимеров из числа известных вам органических молекул.
- Какие связи стабилизируют вторичную, третичную и четвертичную структуры белка?
- Каждый вид живых организмов имеет свой уникальный набор белков. Чем объясняется такое многообразие белковых молекул?
- Найдите в тексте неверные утверждения и исправьте их. Запишите в тетради правильные варианты этих утверждений.
Молекулы белков состоят из остатков D–аминокислот. Замена одного аминокислотного звена другим в молекуле белка всегда приводит к изменению его третичной структуры. Белки, в которых больше аминокислот с гидрофобными радикалами, принимают в воде форму глобулы. Фибриллярные белки нерастворимы, потому что в них больше доля аминокислот с гидрофобными радикалами. При обратимой денатурации белков нарушаются третичная и четвертичная структуры, а при необратимой — первичная.
Это конспект по биологии (углубленное изучение) для 10-класса по теме «Биополимеры. Белки» (УМК Высоцкая, Дымшиц, Рувинский и др). Выберите дальнейшее действие:
- Вернуться к Списку конспектов по Биологии.