Химия 8 Габриелян Контрольная работа № 4
Контрольная работа номер 4 по химии в 8 классе «Растворение. Растворы. Свойства растворов электролитов» с ответами (2 уровня по 2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 62. Контрольная работа по теме «Растворение. Растворы. Свойства растворов электролитов». Цитаты из пособия использованы в учебных целях. Химия 8 Габриелян Контрольная работа № 4.
Контрольная работа № 4
«Растворение. Растворы.
Свойства растворов электролитов»
Цели урока: проверка знаний и умений учащихся, степени усвоения ими учебного материала.
Тип урока: урок развивающего контроля.
Оборудование: карточки с заданиями, справочные таблицы.
ХОД УРОКА
1. Организационный момент
Мотивация к учебной деятельности. Учитель сообщает тему урока, формулирует цели урока.
2. Выполнение контрольной работы
Контрольная работа 4. Базовый уровень

Вариант 1
№ 1. Составьте молекулярные и ионные уравнения возможных реакций взаимодействия соляной кислоты с оксидом натрия, гидроксидом кальция, магнием, серебром, нитратом кальция.
№ 2. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: фосфор → оксид фосфора (V) → фосфорная кислота → фосфат кальция.
№ 3. Закончите молекулярные уравнения реакций, протекающих в растворе, и запишите соответствующие им ионные уравнения: 1) AlCl3+AgNO3 → … ; 2) KOH + H2SO4 → … .
№ 4. Вычислите массу осадка, образовавшегося при взаимодействии 4 г сульфата меди (II) с гидроксидом натрия.
Вариант 2
№ 1. Составьте молекулярные и ионные уравнения возможных реакций взаимодействия гидроксида калия с хлоридом магния, оксидом серы (VI), азотной кислотой, сульфатом натрия.
№ 2. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: барий → оксид бария → гидроксид бария → сульфат бария.
№ 3. Закончите молекулярные уравнения реакций, протекающих в растворе, и запишите соответствующие им ионные уравнения: 1) Сu + AgNO3 → … ; 2) Al + H2SO4 → … .
№ 4. Вычислите массу соли, образовавшейся при взаимодействии 80 г гидроксида натрия с соляной кислотой.
Контрольная работа 4. Усложненный уровень

Вариант 1
№ 1. Свойства каких классов соединений описаны ионными уравнениями? Составьте по одному молекулярному уравнению.
1) 2Н+ + Cu(OH)2 = Сu2+ + 2H2O; 2) Са0 + 2Н+ = Са2+ + H2.
№ 2. Составьте генетический ряд алюминия: алюминий, оксид алюминия, хлорид алюминия, гидроксид алюминия, оксид алюминия. Напишите молекулярные и ионные уравнения реакций по составленной цепочке превращений, назовите типы химических реакций.
№ 3. Составьте два уравнения реакций, в результате которых можно получить сульфат натрия.
№ 4. Вычислите объем водорода, который при нормальных условиях выделяется при взаимодействии 80 г натрия, содержащего 10% примесей, с соляной кислотой.
Вариант 2
№ 1. Свойства каких классов соединений описаны ионными уравнениями? Составьте по одному молекулярному уравнению.
1) 2OH– + SO3 = SO42– + H2O; 2) Cu2+ + 2OН– = Cu(OH)2.
№ 2. Составьте генетический ряд углерода: углерод → оксид углерода (II) → оксид углерода (IV) → карбонат натрия. Напишите молекулярные и ионные уравнения реакций по составленной цепочке превращений, назовите типы химических реакций.
№ 3. Составьте два уравнения реакций, в результате которых можно получить хлорид алюминия:
№ 4. Вычислите объем водорода, который при нормальных условиях выделяется при взаимодействии 75 г цинка, содержащего 10% примесей, с серной кислотой.
3. Рефлексия учебной деятельности
В конце урока учитель раздает на каждую парту краткую запись с ответами на контрольную работу.
ОТВЕТЫ на Базовый уровень
Вариант 1
№ 1. Ответ:
1) 2НCl + Na2O = 2NaCl + H2O;
2Н+ + 2Cl– + Na2O = 2Na+ + 2Cl– + H2O;
2Н+ + Na2O = 2Na+ + H2O;
2) 2НCl + Са(ОН)2 = СаCl2 + 2H2O;
2Н+ + 2Cl– + Са2+ + 2OН– = Са2+ + 2Cl– + 2H2O;
Н+ + ОН– = H2O;
3) Mg + 2НCl = MgCl2 + H2;
2Н+ + 2Cl– + Mg0 = Mg2+ + 2Cl– + H2;
2Н+ + Mg0 = Mg2+ + H2.
4) Соляная кислота не взаимодействует с серебром. В ряду напряжений металлов оно расположено справа от водорода и не вытесняет его из растворов кислот.
5) При сливании растворов соляной кислоты и нитрата кальция не наблюдается признаков реакции — выделения газа, выпадения осадка, образования воды. Химическая реакция не имеет смысла.
№ 2. Ответ:
Р → Р2O5 → Н3РO4 → Са3(РO4)2.
4Р + 5O2 = 2Р2O5;
Р2O5 + 3H2O = 2Н3РO4;
2Н3РO4 + 3Са(ОН)2 = Са3(РO4)2 + 6H2O;
6Н+ + 2РO43– + Са2+ + 2OН– = Ca3(PO4)2↓+ 6H2O.
№ 3. Ответ:
1) AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl;
Al3+ + 3Cl– + 3Ag+ + 3NO3– = Al3+ + 3NO3– + 3AgCl;
Cl– + Ag+ = AgCl;
2) 2KOH + H2SO4 = K2SO4 + 2H2O;
2K+ + 2OH– + 2Н+ + SO42– = 2K+ + SO42– + 2H2O;
Н+ + OH– = H2O.
№ 4.
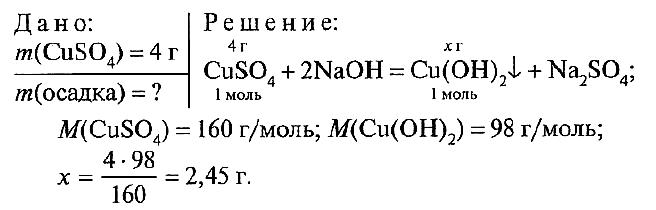
Ответ: m(Cu(OH)2) = 2,45 г.
Вариант 2
№ 1. Ответ
1) 2КОН + MgCl2 = Mg(OH)2 + 2КCl;
2К+ + 2OН– + Mg2+ + 2Cl– = Mg(OH)2 + 2К+ + 2Cl–;
Mg2+ + 2OН– = Mg(OH)2;
2) 2КОН + SO3 = K9SO4 + H2O;
2K+ + 2OH– + SO3 = 2K+ + SO42– + H2O;
2OH– + SO3 = SO42– + H2O;
3) KOH + HNO3 = KNO3 + H2O;
K+ + OH– + Н+ + NO3– = K+ + NO3– + H2O;
OH– + Н+ = H2O.
4) Гидроксид калия не взаимодействует с сульфатом натрия, так как нет признаков реакции — выделения газа, выпадения осадка, образования воды. Химическая реакция не имеет смысла.
№ 2. Ответ:
Ва → ВаО → Ва(ОН)2 → BaSO4.
2Ва + O2 = 2ВаO;
ВаO + H2O = Ва(OН)2;
Ва(ОН)2 + Na2SO4 = 2NaOH + BaSO4↓;
Ва2+ + 2OН– + 2Na+ + SO42– = 2Na+ + 2OH– + BaSO4↓;
Ba2+ + SO42– = BaSO4.
№ 3. Ответ
1) Сu + 2AgNO3 = 2Ag + Cu(NO3)2;
Сu0 + 2Ag+ + 2NO3– = Cu2+ + 2NO– + 2Ag0;
Cu0 + 2Ag+ = Cu2+ + 2Ag0;
2) 2Al + 3H2SO4 = Al2(SO4)3 + 3H2 ↑;
2AI0 + 6Н+ + 3SO42– = 2Al3+ + 3SO42– + 3H2 ↑;
2AI0 + 6Н+ = 2Al3+ + 3H2 ↑.
№ 4.
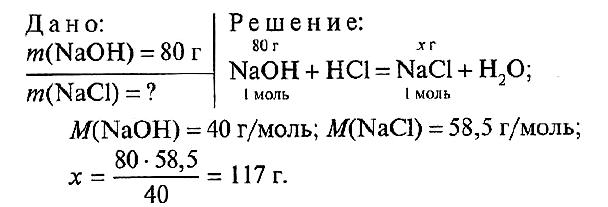
Ответ: m(NaCl) = 117 г.
ОТВЕТЫ на Усложненный уровень
Вариант 1
№ 1. Ответ
1) Н+ — катион водорода, который присутствует в растворах кислот. Сu(ОН)2 — нерастворимое основание. Кислоты взаимодействуют с нерастворимыми основаниями.
2НCl + Cu(OH)2 = СuCl2 + 2H2O;
2) Са0 — активный металл. Н+ — катион водорода, присутствует в растворах кислот. Металлы, стоящие в ряду напряжений левее водорода, вытесняют его из растворов кислот.
Са + 2НCl = СаCl2 + H2.
№ 2. Ответ:
Al → Al2O3 → AlCl3 → Al(ОН)3 → Al2O3.
4Al + 3O2 = 2Al2O3 реакция соединения;
Al2O3 + 6НCl = 2AlCl3 + 3H2O реакция обмена;
Al2O3 + 6Н+ + 6Cl– → 2Al3+ + 6Cl– + 3Н2O;
Al2O3 + 6Н+ → 2Al3+ + 3H2O;
AlCl3 + 3КОН → Al(OH)3 ↓ + 3НCl реакция обмена;
Al3+ + 3Cl– + 3К+ + 3OH– → Al(ОН)3 + 3Н+ + 3Cl–;
Al3+ + 3ОН– → Al(ОН)3;
2Al(ОН)3 → Al2O3 + 3H2O, реакция разложения.
№ 3. Ответ
Na2SO4 — сульфат натрия.
2NaOH + H2SO4 → Na2SO4 + 2H2O;
Na2O + H2SO4 → Na2SO4 + 2H2O.
№ 4.
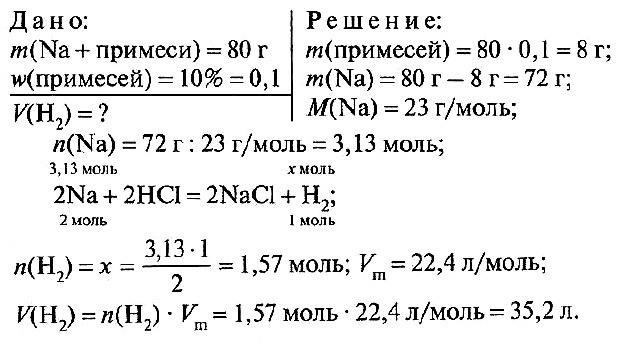
Ответ: V(H2) = 35,2 л.
Вариант 2
№ 1. Ответ:
1) ОН– — гидроксид-анион, присутствует в растворах щелочей. SO3 – оксид серы (IV), кислотный оксид. Кислотные оксиды взаимодействуют с растворимыми основаниями, например
2NaOH + SO3 = Na2SO4 + H2O.
2) Cu2+ — катион меди (II), присутствует в растворах солей меди (II). ОН– — гидроксид–анион, присутствует в растворах щелочей. Растворимые основания взаимодействуют с солями:
CuCl2 + 2КОН = Cu(OH)2 + 2КCl.
№ 2. Ответ:
С → СО → СO2 → Na2CO3.
2С + O2 = 2СО реакция соединения;
2СО + O2 = 2СO2 реакция соединения;
СO2 + Са(ОН)2 = СаСO3 + H2O реакция обмена.
№ 3. Ответ:
1) 2Al + 6НCl = 2AlCl3 + 3H2 ↑;
2) Al(ОН)3 + 3НCl = AlCl3 + 3H2O.
№ 4.
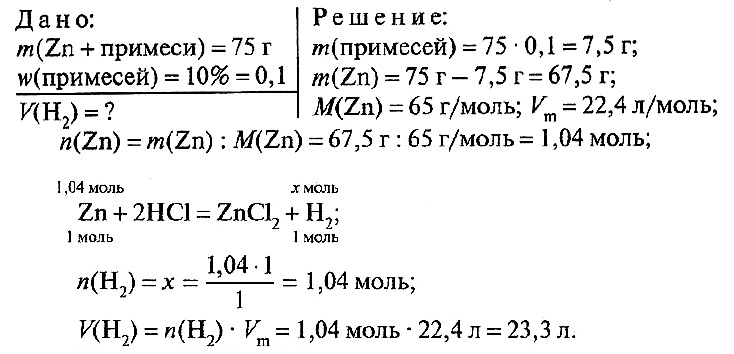
Ответ: V(H2) = 23,3 л.
Вы смотрели: Химия 8 Габриелян Контрольная работа № 4 по химии в 8 классе с ответами (2 уровня по 2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 62. Контрольная работа по теме «Растворение. Растворы. Свойства растворов электролитов» + ОТВЕТЫ.
Смотреть Список всех контрольных по химии в 8 классе по УМК Габриелян.
Вернуться к Списку уроков Тематического планирования по химии в 8 классе.