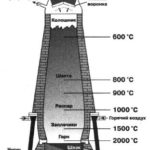
Химические свойства углерода и кремния
Химические свойства углерода и кремния
Ключевые слова конспекта: химические свойства углерода, химические свойства кремния.
Химические свойства углерода
Реакционная способность углерода зависит от аллотропной модификации. Углерод в виде алмаза и графита довольно инертен, устойчив к действию кислот, щелочей, что позволяет изготавливать из графита тигли, электроды и т. д. Более высокую реакционную способность углерод проявляет в виде угля и сажи.
Рассмотрим химические свойства угля, который, как мы уже отметили, является разновидностью графита. Для угля характерна окислительно-восстановительная двойственность. По отношению к большинству неметаллов уголь выступает в роли восстановителя. При нагревании (600–700 °С) уголь сгорает в кислороде или на воздухе:![]()
При температуре выше 1000 °С образуется преимущественно оксид углерода (II) СО.
Углерод реагирует со фтором, но ни уголь, ни углерод в любой другой аллотропной модификации непосредственно не реагирует с другими галогенами.
При температуре примерно 700–800 °С уголь взаимодействует с серой с образованием сероуглерода.
Уголь является хорошим восстановителем и по отношению ко многим сложным веществам. С помощью угля можно восстанавливать некоторые металлы из их оксидов при нагревании (карботермия):![]()
Уголь взаимодействует с водяным паром при t° 800–1000 °С (реакция обратима):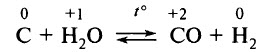
При нагревании уголь взаимодействует с концентрированными серной и азотной кислотами: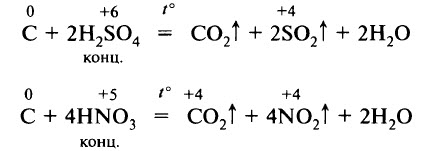
Уголь может также выступать и в роли окислителя, обычно по отношению к металлам и водороду. Уголь взаимодействует с водородом при высоких давлениях (примерно 10 МПа), повышенной температуре и при наличии катализатора. Образуются метан и другие углеводороды: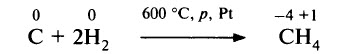
При температуре 1200–1300 °С графит взаимодействует с кремнием, образуя карборунд:![]()
При высоких температурах уголь (графит) взаимодействует с металлами, образуя карбиды:
Химические свойства кремния
Кристаллический кремний достаточно инертен, в аморфной форме он более активен. Кремний реагирует с галогенами. При обычных условиях протекает реакция со фтором:![]()
Кремний реагирует с хлором (при температуре около 400 °С), при более сильном нагревании реагирует с бромом и йодом.
Кремний сгорает в кислороде (при температуре около 1200–1300 °С):![]()
Кремний взаимодействует с азотом (при температуре около 1000 °С) и с углеродом (при температуре 2000 °С), образуя соответственно соединения Si3N4 и SiC. Кремний непосредственно не реагирует с водородом.
С водными растворами кислот кремний не реагирует, кислоты-окислители его пассивируют. Кремний растворяется в щелочах:
Si + 2NaOH + H2O = Na2SiO3 + H2↑
При сплавлении кремния с металлами могут образовываться силициды. Например: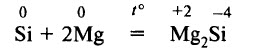
Конспект урока по химии «Химические свойства углерода и кремния». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
Ещё конспекты по теме «Углерод и кремний«: