Соединения серы: сернистый газ и сульфаты
Соединения серы: сернистый газ и сульфаты
Ключевые слова конспекта: соединения серы, сернистый газ, сульфаты, строение, получение, использование.
Оксид серы (IV) — сернистый газ
Оксид серы (IV) SO2 – вещество молекулярного строения, молекула имеет угловую конфигурацию.
При обычных условиях оксид серы (IV) SO2 – бесцветный газ с удушливым запахом, растворим в воде (1 объём воды при комнатной температуре растворяет 36 объёмов SO2).
Оксид серы (IV) SO2 – кислотный оксид.
- Взаимодействует с водой, образуя сернистую кислоту (слабый электролит):
SO2 + H2O ↔ H2SO3
В водном растворе она ступенчато диссоциирует:
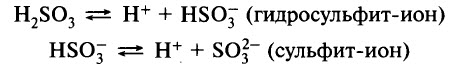
Наличие ионов водорода обусловливает изменение окраски индикатора. Например, при пропускании сернистого газа через раствор лакмуса окраска меняется с фиолетовой на красную.
- Реагирует с основаниями и основными оксидами. В реакциях могут образовываться как средние соли, так и кислые соли (гидросульфиты). Например:
SO2 + 2КОН = K2SO3 + H2О или SO2 + КОН = KHSO3
Так как в SO2 степень окисления серы промежуточная +4, для диоксида серы характерна окислительно-восстановительная двойственность. В реакциях с более сильными восстановителями SO2 – окислитель:![]()
А в реакциях с более сильными окислителями SO2 – восстановитель:![]()
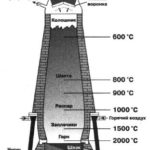
В промышленности сернистый газ получают при обжиге пирита (FeS2) и других сульфидов: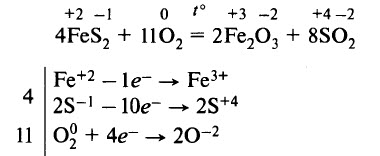
или сжиганием серы в кислороде: S + O2 = SO2
В лаборатории сернистый газ получают действием сильных кислот на сульфиты. Обычно используют концентрированную H2SO4 и твёрдый сульфит натрия Na2SO3:
![]()
Сульфаты
Сульфаты – соли серной кислоты. Серная кислота образует два ряда солей: средние (содержат сульфат–ион SO42–) и кислые (содержат гидросульфат-ион HSO4–).
Сульфаты можно рассматривать как ионные соединения, в узлах кристаллической решётки – катионы металлов и сульфат-анионы.
Сульфаты – твёрдые кристаллические вещества. Большинство сульфатов бесцветны, но окраска может быть обусловлена наличием того или иного катиона (например, медный купорос – кристаллы синего цвета, железный купорос – кристаллы светло–зелёного цвета и т. п.). Растворимость сульфатов в воде различна. Часто сульфаты кристаллизуются в виде кристаллогидратов.
Для распознавания сульфатов можно воспользоваться качественной реакцией на сульфат-ион. Реагентом является растворимая соль бария Ba(NO3)2, ВаCl2, (СН3СОО)2Ва. При взаимодействии реагента с раствором сульфата выпадает белый кристаллический осадок: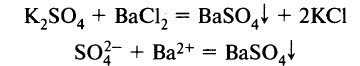
Наиболее распространёнными сульфатами являются:
- Na2SO4 • 10H2О – глауберова соль,
- CaSO4 • 2H2O – гипс,
- 2CaSO4 • H2O – алебастр,
- CuSO4 • 5H2O – медный купорос,
- FeSO4 • 7H2O – железный купорос,
- KAl(SO4) • 12H2O – алюмокалиевые квасцы.
Конспект урока «Соединения серы: сернистый газ и сульфаты».
Следующая тема: «Свойства простых веществ: Азот».