Аммиак. Соли аммония
Аммиак. Соли аммония
Ключевые слова конспекта: аммиак, строение молекулы, свойства, соли аммония, запах аммиака, гипс, азотная кислота, мочевина.
СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА,
ЕГО ФИЗИЧЕСКИЕ СВОЙСТВА
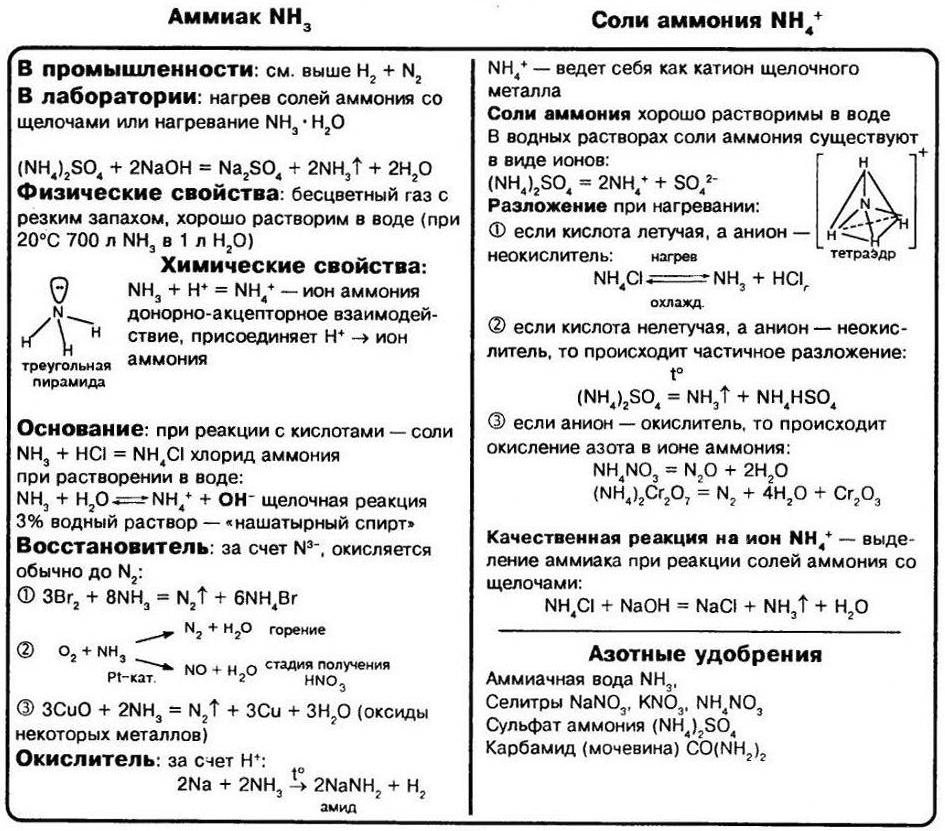
Водородным соединением азота является аммиак NH3. Аммиак – вещество молекулярного строения. Его электронная и графическая формулы изображены на рисунке.
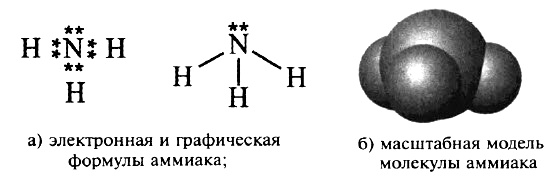
В молекуле NH3 тип химической связи – ковалентный полярный. Электронная плотность смещена к атому азота, на атоме азота – частичный отрицательный заряд δ–, на атомах водорода – частичный положительный заряд δ+.
В молекуле аммиака одинарные связи, так как на атоме азота в молекуле NH3 имеется неподелённая электронная пара. Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно–акцепторному механизму четвёртой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами. Именно поэтому аммиак реагирует с кислотами. Молекула аммиака способна присоединять протон (или ион гидроксония). При этом возникает четвёртая ковалентная связь с атомом водорода по донорно–акцепторному механизму. В результате образуется ион аммония:![]()
При обычных условиях аммиак – бесцветный газ с резким характерным раздражающим запахом. Aммиaк легче воздуха.
Аммиак кипит при температуре –33,3 °С, его температура плавления –77,7 °С. Аммиaк легко сжижается при охлаждении и повышении давления. Он обладает чрезвычайно высокой растворимостью в воде: в одном объёме воды растворяется около 1200 объёмов аммиака при 0 °С, а при +20 °С – 700 объёмов. Разбавленные растворы аммиака (3–10%) называются нашатырным спиртом, концентрированные растворы (18,5–25%) – аммиачной водой.
При работе с аммиаком надо помнить, что даже незначительное содержание его приводит к раздражению слизистой оболочки носа, горла и т. д.
ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
Рассмотрим химические свойства аммиака с позиций окислительно-восстановительных и кислотно-основных взаимодействий.
В молекуле аммиака азот находится в низшей степени окисления (–3), поэтому за счёт азота аммиак обладает только восстановительными свойствами.
Если пропустить ток аммиака по трубке, вставленной в другую широкую трубку, по которой проходит кислород, то аммиак можно зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется свободный азот:![]()
В присутствии катализатора (сплав Pt и Rh) NH3 окисляется кислородом с образованием NO:
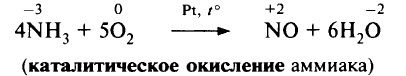
Этот процесс является одной из стадий промышленного получения азотной кислоты.
Аммиаком можно восстановить некоторые неактивные металлы или металлы средней активности из их оксидов:![]()
В кислотно-основных взаимодействиях аммиак проявляет основные свойства. Он взаимодействует с кислотами с образованием солей аммония:
- NH3 + НCl = NH4Cl (хлорид аммония)
- 2NH3 + H2SO4 = (NH4)2SO4 (сульфат аммония)
- NH3 + H2SO4 = NH4HSO4 (гидросульфат аммония)
При растворении аммиака в воде устанавливается следующая совокупность равновесных состояний:
![]()
Поэтому водные растворы аммиака имеют щелочную реакцию.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АММИАКА
Промышленным способом получения аммиака является его синтез из азота и водорода:![]()
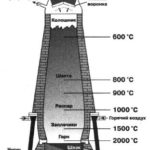
Сырьём является азот, полученный перегонкой жидкого воздуха, и водород, чаще всего получаемый разложением природного газа. Оптимальные условия проведения реакции: t° ≈ 500 °С, р ≈ 1000 атм, катализатор – губчатое железо с добавками (промоторами) К2O, Al2O3. В таких условиях выход аммиака составляет около 50%.
Лабораторным способом получения аммиака является взаимодействие солей аммония со щелочами при нагревании: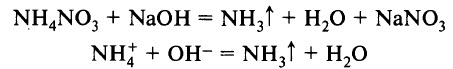
Эта реакция также является качественной реакцией на ион аммония. Её признак – появление запаха аммиака.
Образовавшийся аммиак хорошо растворяется в воде. Для получения аммиака в лаборатории лучше брать сульфат аммония и гидроксид кальция, тогда образующийся сульфат кальция связывает воду, образуется гипс – CaSO4 • 2H2O. Иногда вместо щёлочи используется натронная известь – смесь СаО и NaOH. Реакцию ведут при нагревании:
(NH4)2SO4 + Са(ОН)2 = CaSO4 + 2NH3↑ + 2H2O
Аммиак применяется для получения азотной кислоты HNO3, мочевины (H2N–СО–NH2) – ценного удобрения, для получения соды (Na2CO3) по аммиачному методу, для аминирования органических веществ. Жидкий аммиак и его водные растворы используются как жидкие удобрения. Аммиак применяется как хладагент в холодильниках (NH3 легко сжижается, а затем испаряется с поглощением большого количества теплоты). В медицине используется 10%-й раствор – нашатырный спирт.
СОЛИ АММОНИЯ
Соли аммония, как и другие соли, являются ионными соединениями, образованными катионами аммония NH4+ и анионами кислотных остатков. По многим свойствам соли аммония похожи на соли натрия и калия. При обычных условиях это твёрдые кристаллические вещества, бесцветные, если анион кислотного остатка не обусловливает какую–либо окраску.
Соли аммония разлагаются при нагревании. Состав продуктов реакции термического разложения зависит от природы кислотного остатка (аниона):
а) если соль аммония образована летучей кислотой и её анион не является сильным окислителем, то такая соль полностью разлагается с образованием соответствующих газов: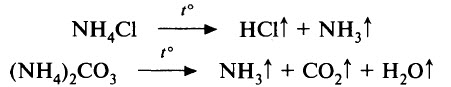
б) если в состав соли аммония входит анион, обладающий окислительной способностью, то при нагревании происходит окислительно–восстановительная реакция. Так, при нагревании нитрата или нитрита аммония происходит конпропорционирование (в результате степени окисления азота «сходятся»):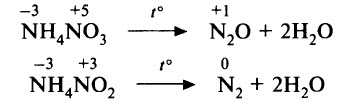
А нагревание дихромата аммония приводит к образованию оксида хрома(III), эту реакцию часто используют для имитации «вулканчика»:![]()
Соли аммонию реагируют со щелочами с образованием аммиака:![]()
Данную реакцию можно рассматривать как качественную на наличие ионов аммония. При нагревании аммиак улетучивается за счёт уменьшения его растворимости. Это легко определяется по характерному запаху аммиака и по окрашиванию влажной лакмусовой бумаги в синий цвет.
Конспект урока «Аммиак. Соли аммония».
Следующая тема: «».